
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
【答案】有机合成材料 聚乙烯醇分子中含有大量羟基,易与水分子之间形成氢键 1:2 不变 > 3.2 C A d
【解析】
(1)由题意可知聚乙烯醇属于有机合成材料;聚乙烯醇含有羟基,具有亲水性,烃基则具有憎水性;
(2)投料比不同,转化率大小的比较,对于给定的化学反应,化学平衡常数仅受温度影响;
(3)吸热反应温度越高反应物的转化率越大,放热反应温度越高反应物的转化率越小,结合图形判断温度的变化对速率的影响,温度对化学反应速率的影响,温度越高反应速率越快;
(4)理解催化剂在反应中,参与反应历程,降低反应的活化能,但是不改变反应热,不改变平衡常数,不改变平衡转化率。
(1)聚乙烯醇属于有机合成材料;聚乙烯醇中含有大量的亲水基团羟基,并且羟基与水分子之间可以形成氢键;
(2)两种反应物,当乙酸甲酯的物质的量一定时,己醇的投入的量越大,乙酸甲酯的转化率越大,故初始投料比1:2的时候,乙酸甲酯转化率最大;对于给定的化学反应方程式,化学平衡常数只受温度的影响,与投料比的多少没有关系,与按1:2投料相比,按2:1投料时化学平衡常数Kx不变;
(3)温度越高反应速率越快,反应到达平衡的时间越短,①曲线的温度为348K,②曲线的温度为343K,③曲线的温度为338K,从图形上可知,温度越高乙酸甲酯转化率越大,故该反应为吸热反应,ΔH>0; CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),由方程式可知,反应物的化学计量数之比与投料比相同,故CH3COOCH3(l)、C6H13OH(l)的转化率相同,①曲线的温度348K时,平衡时的转化率为64%,设初始投料时n(CH3COOCH3(l))=n(C6H13OH)=xmol,则达到平衡时,n(CH3COOCH3) =n(C6H13OH) =0.36xmol,n(CH3COOC6H13)=n(CH3OH) =0.64xmol,平衡时它们的物质的量分数分别为:X(CH3COOCH3)=X(C6H13OH)=(0.36xmol)/(0.36xmol+0.36xmol+0.64xmol+0.64xmol) ×100%=18%,X(CH3COOC6H13)=X(CH3OH)= (0.64xmol)/(0.36xmol+0.36xmol+0.64xmol
CH3COOC6H13(l)+CH3OH(l),由方程式可知,反应物的化学计量数之比与投料比相同,故CH3COOCH3(l)、C6H13OH(l)的转化率相同,①曲线的温度348K时,平衡时的转化率为64%,设初始投料时n(CH3COOCH3(l))=n(C6H13OH)=xmol,则达到平衡时,n(CH3COOCH3) =n(C6H13OH) =0.36xmol,n(CH3COOC6H13)=n(CH3OH) =0.64xmol,平衡时它们的物质的量分数分别为:X(CH3COOCH3)=X(C6H13OH)=(0.36xmol)/(0.36xmol+0.36xmol+0.64xmol+0.64xmol) ×100%=18%,X(CH3COOC6H13)=X(CH3OH)= (0.64xmol)/(0.36xmol+0.36xmol+0.64xmol
+0.64xmol) ×100%=32%,348K时,以物质的量分数表示的化学平衡常数Kx=![]() =3.2;C点的时候,生成物浓度比较大,温度比较高,故逆反应速率最大;A点的时候,反应物浓度比较大,温度比较高,A点的时候,正反应速率比较大;
=3.2;C点的时候,生成物浓度比较大,温度比较高,故逆反应速率最大;A点的时候,反应物浓度比较大,温度比较高,A点的时候,正反应速率比较大;
(4)a.催化剂参与反应,改变反应历程,a错误;
b.催化剂不能改变平衡移动的方向,不能改变平衡时反应物的转化率,b错误;
c.催化剂降低反应的活化能,c错误;
d.催化剂降低反应的活化能,能同等倍数的提高正、逆反应速率,d正确;
答案选d。


科目:高中化学 来源: 题型:
【题目】合成氨工业中的原料气制取与净化是重要的环节。
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
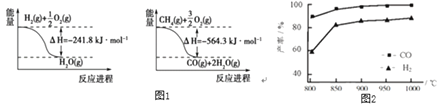
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.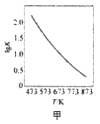 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.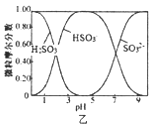 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C. 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.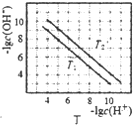 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFePO4 + e- + Li+ = LiM1-xFexPO4 ,其原理如图所示,下列说法正确的是( )
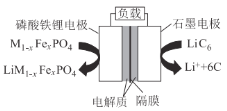
A.电池总反应为 M1-xFexPO4 + LiC6 = LiM1-xFexPO4 + 6C
B.放电时,负极LiC6 中碳元素失去电子变为单质
C.放电时,电流由石墨电极流向磷酸铁锂电极
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.NaHS溶液中:K+、S2-、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y 、Z、W是原子序数依次增大的短周期主族元素,其中Z的最外层电子数与X的核外电子总数相等。X、Z、W形成的一种化合物结构为![]() ,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
A.元素非金属性:X>Y>Z
B.简单离子半径:Y<Z< W
C.工业上常通过电解W与Z形成的化合物制备W单质
D.简单气态氢化物的稳定性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO![]() )="0.1" mol·L-1的溶液中:NH
)="0.1" mol·L-1的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.有大量![]() 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量![]() 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH![]() 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO![]() 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。己知:断裂N4(g)中1molN-N键吸收193kJ能量,形成N2(g)中1 molN≡N放出941 kJ能量。下列说法正确的是

A. 形成1 molN4(g)中的化学键放出193kJ的能量
B. N4(g)比N2(g)更稳定
C. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
D. N4(g) =2N2(g) △H=724kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化
B.对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
C.pH=6的某溶液一定呈酸性
D.二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com