
【题目】高血脂是一种常见的心血管疾病.治疗高血脂的新药I的合成路线如图所示:

已知:a.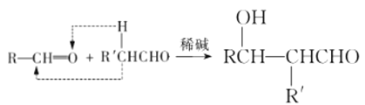 ;
;
b.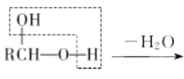 RCHO
RCHO
请回答下列问题:
(1)反应①所需试剂、条件分别是____。
(2)A→B的化学方程式为____。
(3)G的结构简式为____。
(4)化合物W的相对分子质量比化合物C大14。且满足下列条件.W的可能结构有___种。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
其中核磁共振氢谱显示有5种不同化学环境的氢.且峰面积比为2:2:2:1:1的结构简式为___
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)____。
目标产物)____。
【答案】Cl2、光照 2![]() +O2
+O2![]() 2
2![]() +2H2O
+2H2O ![]() 13
13 ![]()
![]()
【解析】
(1)-(4)甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则E为HCHO,CH3(CH2)6CHO和甲醛反应生成G,根据题给信息知G为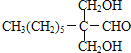 ,G和氢气发生加成反应生成H为
,G和氢气发生加成反应生成H为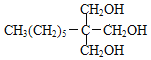 ;甲苯在光照条件下与氯气发生取代反应生成
;甲苯在光照条件下与氯气发生取代反应生成![]() ,
,![]() 水解得到A为
水解得到A为![]() ,A氧化生成B为
,A氧化生成B为![]() ,B进一步氧化生成C为
,B进一步氧化生成C为![]() ,C与H发生酯化反应生成I为
,C与H发生酯化反应生成I为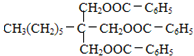 ;
;
(5)苯与氯气在光照条件下生成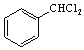 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物。
,最后与乙醛在碱性条件下反应生成目标物。
(1)反应①是甲苯转化为![]() ,所需试剂、条件分别是:氯气、光照;
,所需试剂、条件分别是:氯气、光照;
(2)A→B 的化学方程式为:![]() ;
;
(3)G 的结构简式为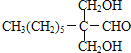 ;
;
(4)化合物W 的相对分子质量比化合物C (![]() )大14,W比C多1个CH2原子团,W满足下列条件:①遇FeCl3 溶液显紫色,说明含有酚羟基,②属于芳香族化合物,即含有苯环,③能发生银镜反应,还含有醛基,含有2个侧链为-OH、-CH2CHO,有邻、间、对3种,含有3个侧链为-OH、-CH3、-CHO,而OH、-CH3有邻、间、对3种位置,对应的-CHO分别有4种、4种、2种位置,故符合条件的W共有3++4+2=13种,其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1的W 的结构简式为:
)大14,W比C多1个CH2原子团,W满足下列条件:①遇FeCl3 溶液显紫色,说明含有酚羟基,②属于芳香族化合物,即含有苯环,③能发生银镜反应,还含有醛基,含有2个侧链为-OH、-CH2CHO,有邻、间、对3种,含有3个侧链为-OH、-CH3、-CHO,而OH、-CH3有邻、间、对3种位置,对应的-CHO分别有4种、4种、2种位置,故符合条件的W共有3++4+2=13种,其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1的W 的结构简式为:![]() ;
;
(5)苯与氯气在光照条件下生成 ,然后发生水解反应生成
,然后发生水解反应生成![]() ,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为:
,最后与乙醛在碱性条件下反应生成目标物,合成路线流程图为: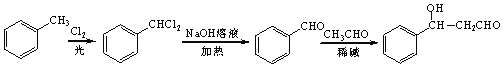 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y= 或
或 ],与pH的变化关系如图所示。则下列说法一定错误的是( )
],与pH的变化关系如图所示。则下列说法一定错误的是( )

A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.直线Ⅱ中M、N点一定存在c2(HSO![]() )>c(SO
)>c(SO![]() )·c(H2SO3)
)·c(H2SO3)
D.当对应溶液的pH处于1.81<pH<6.91时,溶液中的一定存在:c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO3)
)>c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构简式如下图所示。下列关于有机物X的说法正确的是

A. X化学式为C8H6O6
B. X可发生加成反应、水解反应和氧化反应
C. X分子中所有的原子一定在同一平面内
D. X能使溴水和KMnO4溶液褪色,原因均与分子中碳碳双键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除NO是环境治理的重大课题。回答下列问题:
(1)NaClO2氧化去除NO
已知:5 NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq) △H1
5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq) △H2
则反应4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)
△H=_____(用含△H1、△H2的代数式表示)
(2)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为NO2﹣+S2O82﹣+2OH﹣NO3﹣+2SO42﹣+H2O。
不同温度下,平衡时NO2﹣的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。

①平衡时b、d两点的浓度:c(S2O82﹣)b_____c(S2O82﹣)d(填“>”、“<”或“=”)
②a、b、c三点平衡常数K由大到小的顺序为_____,原因是_____。
③常温下,反应中NO2﹣、S2O82﹣的初始浓度均为 x molL﹣1,反应达平衡时溶液pH=14,NO3﹣浓度为 y molL﹣1(忽略反应前后溶液体积的变化),该反应的化学平衡常数为_____。
(3)连二亚硫酸钠(Na2S2O4)还原去除NO。若用连二亚硫酸钠(Na2S2O4)溶液还原NO去除污染,再电解生成的NaHSO3,可再生Na2S2O4,其电解过程如图所示,质子膜允许H+和H2O通过。阴极的电极反应式为_____,将处理 n molNO后的溶液电解至恰好完全再生时,理论上生成的O2在标准状况下的体积为_____L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
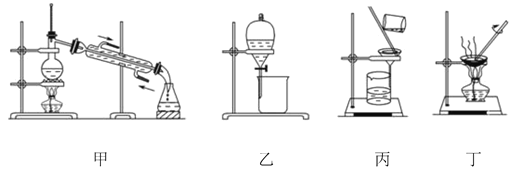
(1)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

a.灼烧海带时,除需要三脚架、泥三角外,还需要用到实验仪器是_____(填字母)。
A.烧杯 B.坩埚 C.表面皿 D.酒精灯 E. 干燥器
b.步骤③的实验选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑤的实验操作名称是_____。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。
(2)某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新材料的研制与应用始终是科技发展的主要方向之一。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____。
(2)硼及其化合物广泛应用于永磁材料、超导材料等领域,硼可以与氟气反应生成BF3气体,BF3分子的立体构型为___________。
(3)石墨的晶体结构如图所示,如图虚线勾勒出的是其晶胞。则石墨晶胞含碳原了个数___________。碳的两种同素异形体中键长较短的是___________(填“石墨”或“金钢石”)。

(4)石墨烯(图甲〕是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)

图乙中,1号C的杂化方式是___________,该C与相邻C形成的键角___________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(5)有机太阳能固体电池材料含有高纯度C60,其分子结构如图,1molC分子中π键的数目为___________。C60能溶于二硫化碳而不溶于水的原因是___________。C60的晶胞与干冰的晶胞相似,已知该晶胞的密度为ρg·cm-3,则两个最近C60分子间的距离为___________nm(列出计算式,已知阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com