
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������m��p��q��r��s������ЩԪ����ɵĶ�Ԫ��������³�ѹ��rΪ�ճ������������Һ�壬�����Ϊ��ɫ���壬m��Ħ������Ϊp��2����n��Ԫ��Y�ĵ��ʣ�����ɫֲ�������ò�������ɫ���壬p��ʹʪ��ĺ�ɫʯ����ֽ������q��ʹƷ����Һ��ɫ����������֮���ת����ϵ��ͼ��ʾ������˵����ȷ����
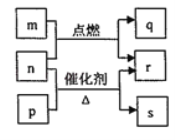
A.m��r��������ѧ��������ͬ
B.r�ķе����p�ķе�
C.m��q���û����������
D.q��s��Ϊ���������m��ˮ��Һ������
���𰸡�AB
��������
������Ԫ��W��X��Y��Z��ԭ�������������ӣ�m��p��q��r��s������ЩԪ����ɵĶ�Ԫ��������³�ѹ��rΪҺ�壬��rӦΪ![]() �������Ϊ��ɫ���壬n��Ԫ��Y�ĵ��ʣ�����ɫֲ�������ò�������ɫ���壬��YΪOԪ�أ�nΪ
�������Ϊ��ɫ���壬n��Ԫ��Y�ĵ��ʣ�����ɫֲ�������ò�������ɫ���壬��YΪOԪ�أ�nΪ![]() ��p������ʹʪ��ĺ�ɫʯ����ֽ��������pΪ
��p������ʹʪ��ĺ�ɫʯ����ֽ��������pΪ![]() ��WӦΪH��XӦΪNԪ�أ�����ת����ϵ�������������ڴ�������������r��s������sΪ
��WӦΪH��XӦΪNԪ�أ�����ת����ϵ�������������ڴ�������������r��s������sΪ![]() ��m ��Ħ������Ϊp��2����m��n��ȼ�����ɵ�q��ʹƷ����Һ��ɫ��mӦΪ
��m ��Ħ������Ϊp��2����m��n��ȼ�����ɵ�q��ʹƷ����Һ��ɫ��mӦΪ![]() ��qӦΪ
��qӦΪ![]() ������ZӦΪSԪ�أ�������������ȼ�����ɶ��������ˮ������ת����ϵ��
������ZӦΪSԪ�أ�������������ȼ�����ɶ��������ˮ������ת����ϵ��
��������������mΪ![]() ��nΪ
��nΪ![]() �� pΪ
�� pΪ![]() ��qΪ
��qΪ![]() ��rΪ
��rΪ![]() ��sΪ
��sΪ![]() ��
��
A��![]() ��
��![]() ��������ѧ����Ϊ���Թ��ۼ���������ͬ��A��ȷ��
��������ѧ����Ϊ���Թ��ۼ���������ͬ��A��ȷ��
B��![]() �ķе����
�ķе����![]() �ķе㣬B��ȷ��
�ķе㣬B��ȷ��
C��![]() ��
��![]() ��Ϸ�����Ӧ��
��Ϸ�����Ӧ��![]() ����۲쵽�е���ɫ�������ɣ�C����
����۲쵽�е���ɫ�������ɣ�C����
D��![]() ���������
Ϊ���������![]() ���ڲ����������
���ڲ����������![]() ��ˮ��Һ�����ԣ�D����
��ˮ��Һ�����ԣ�D����
�ʴ�ѡAB��


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ��ijƽ����ϵ�к���X��Y��Z��W�������ʣ����¶��·�����Ӧ��ƽ�ⳣ������ʽΪK��![]() ���йظ�ƽ����ϵ��˵����ȷ����
���йظ�ƽ����ϵ��˵����ȷ����
A. ����������ƽ����Է����������ֲ���ʱ����Ӧ��ƽ��
B. ����ѹǿ�������ʵ�Ũ�Ȳ���
C. �����¶ȣ�ƽ�ⳣ��K����
D. ����X������ƽ��ȿ��������ƶ���Ҳ���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����(����٤������ΪNA)(����)
A.������ˮ��Ӧ�����ӷ���ʽ��Cl2��H2O=2H����Cl����ClO��
B.15.6��Na2O2����������������Ϊ0.3NA
C.11��D218O�к��е�����Ϊ6NA
D.![]() ��
��![]() ��������ͬ�������ڲ�ͬ�ֺ���
��������ͬ�������ڲ�ͬ�ֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ǽ���Ԫ��A��B��C��D��E�����ڶ�����Ԫ�أ���ԭ��������������AԪ��ԭ���γɵ����Ӻ��������Ϊ�㣬Bԭ�ӵ��������������ڲ��������2����ͨ��״����E�ĵ����ǻ�ɫ���壬������ˮ�������ڶ���̼��D��E��ͬһ���壬C��D�����ڱ��д������ڵ�λ�ã���ش��������⣺
(1)AԪ�ص�������________��E�������ӽṹʾ��ͼ��__________________��
(2)Ԫ��C������������Ӧˮ����������̬�⻯�ﷴӦ���ɻ�����Z���÷�Ӧ�����ӷ���ʽΪ____________________________________________��������Z����________________(�������ӻ��������������ۻ�������)��Z�к��еĻ�ѧ��������________________��
(3)CԪ�ص�����������Ӧ��ˮ�����ϡ��Һ����D��EԪ���γɵ�һ�ֻ������������ԭ��Ӧ�������ӷ�Ӧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ��������г������л�������й��Ҵ���ʵ�������ʵ��������ȷ����
A.��������KMnO4��Һ����ɫ���Ҵ�ת��Ϊ��ȩ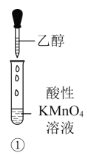
B.�����ƻ����Ҵ��ڲ������������Ϸ��Ļ���Ϊ����ɫ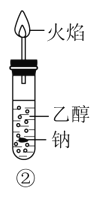
C.�������ȵ�ͭ˿�����Ҵ��У�ͭ˿�ɺ�ɫ��Ϊ��ɫ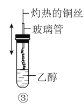
D.����X�DZ���NaOH��Һ��XҺ��������״Һ������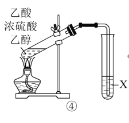
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���⣺
1-�������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�棬�ܶ�Ϊ1.36g��cm-3��ʵ�����Ʊ����� 1-��������Ҫ�������£�
���� 1�������� A �м��������ӡ�12g �������� 20mLˮ����ˮ��ȴ�»������� 28mlŨ H2SO4����ȴ�����£������¼��� 24gNaBr��
(��֪�� ��2NaBr+H2SO4(Ũ)![]() Na2SO4+2HBr��
Na2SO4+2HBr��
����������Ũ���Ṳ�Ȼ������ϩ���ѵȸ���Ʒ)
���� 2����ͼ��ʾ�ʵ��װ�ã��������ȣ�ֱ������״�����Ϊֹ��
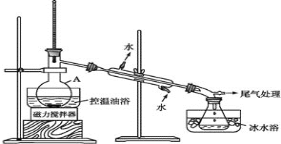
���� 3�������Һת���Һ©�����ֳ��л��ࡣ
���� 4�����ֳ����л���ת���Һ©���������� 12mLH2O��12ml5%Na2CO3 ��Һ��12mLH2O ϴ�ӣ���Һ���ôֲ�Ʒ����һ���ᴿ�� 1-����顣
(1)���� A ��������_____��
(2)��Ӧʱ���ɵ���Ҫ�л������� 2-������_______(���һ�ּ��ɸ���)
(3)���� 2 ���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����____��
(4)���� 1 ��Ũ H2SO4 ��ˮϡ�ͣ�����ȴ�����º��ټ� NaBr ��Ŀ����______������ 4 ���� Na2CO3 ��Һϴ�ӵ�Ŀ����_____��
(5)���� 4 �н�һ���ᴿ 1-�����ķ�����_________���ڽ��д˲���֮ǰ��Ҫ ����ˮMgBr2 �����ֲ�Ʒ����Ŀ����_____��
(6)1-�������һ��������Ҳ�����Ʊ� 1-����,��д���ɲ��� 1-������Ʊ� 1-�����Ļ�ѧ��Ӧ����ʽ________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ƣ�Na2S2O4����Ҳ��Ϊ���շۣ�Na2S2O4������ˮ���������Ҵ������м�ǿ�Ļ�ԭ�ԣ��ױ������������ڼ��Խ������ȶ����������ӵĽṹ��ͼ��ʾ��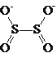 ��ij����С���Ʊ���̽�������ʡ�
��ij����С���Ʊ���̽�������ʡ�
�����Ʊ�Na2S2O4�����ȵȸ���������ȥ��
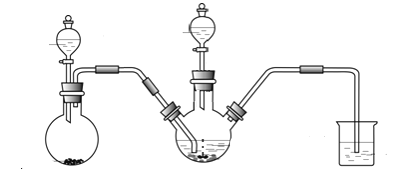
��1��Na2S2O4����Ԫ�صĻ��ϼ�Ϊ_______��
��2�����Ӻ�װ�ú�������������õIJ�����____________________��
��3������ҩƷ���ٴ����Ӻ�װ�ã�
����һ������A�����ɵ�����ͨ��B�н��з�Ӧ����Bװ����������������п�Ļ��Ϸ�Ӧ����ʽΪ__________��
���ڶ���������NaOH��Һ����28��35���·�Ӧ����Na2S2O4���ò���Ӧ�����ӷ���ʽΪ_____________��
�����������ڶ����Ļ������ˣ�������Һ�м������NaCl����ȴ��20��������Na2S2O4����������
�����IJ��������������û���ᆳ________����������ƣ���________(��д ��ˮ�������Ҵ���)ϴ�ӣ��õ�������Na2S2O4���塣
��4��װ��C�������� _______________��
����̽��Na2S2O4���ȶ���
��5��������������Na2S2O4������ȫ�ֽ�õ��������Na2SO3��Na2S2O3��SO2��������С��û��������ȫ�����������õ��Ĺ�������л�����Na2SO4�������ʵ��֤���÷ֽ�����к���Na2SO4��ʵ�鷽����______________������ѡ�Լ���ϡ���ᡢϡ���ᡢϡ���ᡢBaCl2��Һ��AgNO3��Һ��KMnO4��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ��̽���������CO2������Na2O2��Ӧ��������ʪ��CO2����Na2O2��Ӧ�������������װ�ý���ʵ��(�г�������ʡ��)��
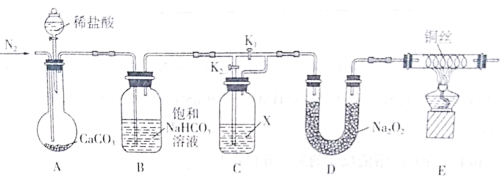
�ش��������⣺
(1)ʵ�鿪ʼǰ��ͨ��һ��ʱ���N2��Ŀ����________��
(2)����NaHCO3��Һ��������_________���Լ�X��___________��
(3)ʵ��ʱ�����ȴ�װ��A�з�Һ©���Ļ���������ϡ���Ȼ��ر�K1����K2��ʵ���й۲쵽E�����ȵ�ͭ˿��ɫδ�����仯����ó��Ľ�����_______��
(4)��_____(�����)��E�����ȵ�ͭ˿��Ϊ��ɫ����֤����ʪ��CO2����Na2O2��Ӧ��
(5)д��D��CO2��Na2O2��Ӧ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AgBrO3)��KNO3���ܽ�����¶ȱ仯������ͼ��ʾ��


���з���������ǣ� ��
A.60��ʱ��AgBrO3��������Һ��Ũ����0.596%
B.�¶�����ʱAgBrO3����KNO3�ܽ��ٶȶ��ӿ�
C.�¶ȶ�AgBrO3���ܽ�ȵ�Ӱ��ȶ�KNO3�ܽ�ȵ�Ӱ���
D.KNO3������AgBrO3�����ؽᾧ�ķ�����ȥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com