
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
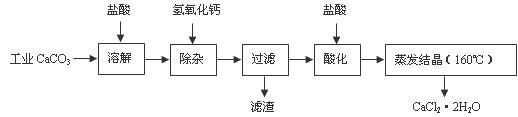
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①
;② 。
(3)测定样品中Cl- 含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①计算上述样品中CaCl2·2H2O的质量分数为 。
②若用上述办法测定的样品中CaCl2·2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有
【知识点】物质分离和提纯的方法和基本操作综合应用;中和滴定.
【答案解析】(1)取少量上层清液与试管中(1分),滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全(1分)。
(2)①将溶液中的少量Ca(OH)2转化为CaCl2;②防止溶液吸收空气中CO2
或者答:防止Ca2+在蒸发时水解(答到任意两个都给分)
(3)①99.91% (未保留四位有效数字扣一分) ②样品中存在少量的NaCl;少量的CaCl2·2H2O失水。
解析:(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在应选用KSCN溶液,所需操作为取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)因在除杂过程中加入了Ca(OH)2,故加入盐酸与溶液中的少量Ca(OH)2反应使其转化为CaCl2;另Ca(OH)2易吸收空气中的CO2,生成CaCO3沉淀,故加入盐酸还可以防止溶液吸收空气中CO2;
(3)
②样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2.2H2O),则
n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,
则有:0.7493325/0.7500×100%=99.9%;
③样品中存在少量的NaCl会导致CaCl2.2H2O的物质的量增大,同样若CaCl2.2H2O失水导致分母变小,值偏大。
【思路点拨】此题主要考查实验的基本操作、实验仪器的选择、实验误差分析.注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
可逆反应:A+3B 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( )
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( )
A.②>④>③>① B.②>③=④>①
C.④>②=③>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为____________
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________
在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g);
2SO3(g);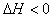
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A.若M(甲)<M(乙),则气体的压强:甲>乙
B.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
C.若M(甲)>M(乙),则气体体积:甲<乙
D.若M(甲)<M(乙),则分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2氯苯甲醛为原料的合成路线如下:

(1)分子D中的非含氧官能团名称为________________。
(2)X的结构简式为____________。
(3)分子C可在一定条件下反应生成一种含有3个六元环的产物,写出该反应的化学方程式________________________________。
(4)物质D有两种结构,但只有一种能合成具有药理作用的氯吡格雷。物质D有两种结构的原因是 。
(5)D→E的反应类型是________反应。
(6) A的属于芳香族化合物的所有同分异构体(不包括A)有_____种。
(7)已知: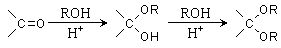

则由乙醇、甲醇为有机原料制备化合物 ,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有__________(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应_________________________________________。
的最后一步反应_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,下列说法中正确的是
A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com