解答:解:(1)若X是强氧化性单质,A是单质,则A和X形成的化合物有变价元素,
a.S和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,所以符合转化关系;
b.N
2和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以符合转化关系;
c.Na和氧气反应生成氧化钠,氧化钠和氧气反应生成过氧化钠,所以符合转化关系;
d.Mg和氧气反应生成氧化镁,氧化镁和氧气不反应,所以不符合转化关系;
e.Al和氧气反应生成氧化铝,氧化铝和氧气不反应,所以不符合转化关系;
故选d e;
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A和B能被氧化,则X是氧气,A是醇,B是醛,C是羧酸,A与C反应生成D,D是酯,D的相对分子质量为88,则D是乙酸乙酯,所以C的官能团是羧基,在铜作催化剂、加热条件下,乙醇被氧化生成乙醛,反应方程式为:2CH
3CH
2OH+O
2 2CH
3CHO+2H
2O,
故答案为:羧基,2CH
3CH
2OH+O
2 2CH
3CHO+2H
2O;
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则A和X的反应与量有关,且B是氢氧化铝,A可能是氢氧化钠和盐酸,氯化铝和氢氧化钠反应生成氢氧化铝,偏铝酸根离子和酸反应生成氢氧化铝,离子反应方程式为:Al
3++3OH
-=Al(OH)
3↓,AlO
2-+H
++H
2O=Al(OH)
3↓,
故答案为:Al(OH)
3,NaOH(或KOH)、HCl(或其它强酸),Al
3++3OH
-=Al(OH)
3↓;AlO
2-+H
++H
2O=Al(OH)
3↓;
(4)若 X 是金属单质,向C的水溶液中滴加AgNO
3溶液,产生不溶于稀HNO
3的白色沉淀,则C中含有氯离子,且X是变价金属,则为铁,所以C是氯化亚铁,B是氯化铁,A是氯气,氯气的电子式为:

,
亚铁离子易被氧气氧化生成铁离子而变质,为防止变质,C溶液在贮存时应加入少量X,铁和铁离子反应生成亚铁离子,离子反应方程式为:2Fe
2++Fe=3Fe
3+,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,向溶液中滴加硫氰化钾溶液,如果溶液呈血红色,则证明含有铁离子,如果无颜色变化,再滴加氯水,溶液呈红色,则证明含有亚铁离子,
故答案为:

;2Fe
2++Fe=3Fe
3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe
2+存在.




 ,
, ;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.
;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.

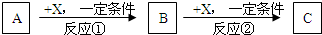

 现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
