
【题目】常温下,H2SO3的电离常数:Ka1=1.54×102,Ka2=1×107。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是
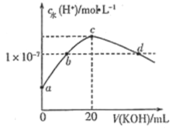
A.m=10
B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH的K=1×107
【答案】C
【解析】
A. 根据水的电解程度最大为c点,则说明H2SO3与KOH恰好完全反应生成K2SO3,则2n(H2SO3) = n(KOH),2×0.1mol/L×mmL=0.1mol·L1 ×20mL,解得m=10,故A正确;
B. c点对应的溶液中溶质为K2SO3,根据电荷守恒得到c(K+)+ c(H+) = c(OH-) + c(HSO3-)+2c(SO32),溶液呈碱性即 c(OH-)>c(H+),因此有c(K+) >c(HSO3-)+2c(SO32),故B正确;
C. a点呈酸性,c点呈碱性,从酸性到碱性,因此b呈中性,pH=7,d是在c点呈碱性基础上再加KOH,则d点依然是碱性,即d点溶液的pH>7,故C错误;
D. SO32-+H2OHSO3-+OH的![]() ,故D正确;
,故D正确;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )

A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、E、F是短周期主族元素,且原子半径依次增大。在短周期中A元素原子半径最小,A与F可形成离子化物FA,C的简单氢化物常用作制冷剂,D、E、F同周期,B、E同主族。回答下列问题:
(1)G是E下一周期同主族元素,G的原子结构示意图为__________。
(2)A与F形成离子化物FA的电子式为___________。
(3)化学家发现一种原子组成比为A4C4的离子化合物,则该化合物的化学式为_______。
(4)C2A4B3是一种常见的炸药,其在常温下撞击时会生成一种气体(C2B)和一种常见液体,该反应的化学方程式为______________。16g该物质反应转移的电子数目为________。
(5)请设计最简单实验说明元素D、E的非金属性强弱:________________________________(简要说明原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种物质有如下转化关系(反应条件和其他产物已省略),下列选项不可能的是( )
![]()
A.M:Na X:O2
B.M:HNO3X:Fe
C.M:Al X:NaOH
D.M:NH3X:O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
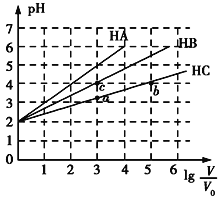
A.常温下:Ka(HB)>Ka(HC)
B.HC的电离度:a点<b点
C.当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度,![]() 减小
减小
D.当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】头孢拉定又名先锋霉素,是常用的一种抗生素,其结构简式如图:
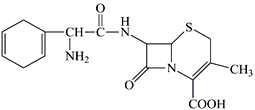
下列说法不正确的是( )
A. 头孢拉定的分子式是C16H19N3O4S,分子中有多种官能团
B. 头孢拉定与Na2CO3溶液、NaHCO3溶液都可以反应
C. 1mol头孢拉定最多可与6molH2和5mol Br2发生加成反应
D. 头孢拉定既可与盐酸反应,也可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以白云石(主要含CaCO3)为原料,按以下工艺流程制备某种新型的超导材料12CaO·7Al2O3。
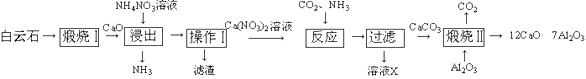
(1)若在实验室中进行“煅烧Ⅰ”的操作,可将样品放在_____________(填仪器名称)中加热;操作Ⅰ的名称是_____________。
(2)“浸出”过程中,CaO先与水反应生成Ca(OH)2,写出Ca(OH)2与NH4NO3溶液反应的化学方程式:_____________;检验“浸出”过程中有NH3生成的方法是___________。
(3)溶液X在流程中能循环利用,其中所含主要溶质的化学式为______。
(4)“煅烧Ⅱ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com