


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源: 题型:




| 44b |
| 3a |
| 44b |
| 3a |
查看答案和解析>>
科目:高中化学 来源: 题型:
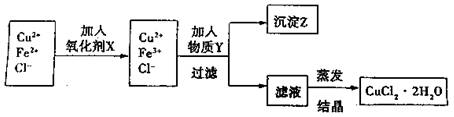
(15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
已知:
|
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是 。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加紧入的物质Y是 。
②写出沉淀Z在水中的沉淀溶解平衡方程式: 。
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是 。
(4)①某同学利用反应:Cu+2H+===Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省协作体高三3月调研理综部分(解析版) 题型:填空题
(15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
已知:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是 。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加紧入的物质Y是 。
②写出沉淀Z在水中的沉淀溶解平衡方程式: 。
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是 。
(4)①某同学利用反应:Cu+2H+===Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(5)已知一些难溶物的浓度积常数如下表:
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三上学期期末检测化学试卷 题型:填空题
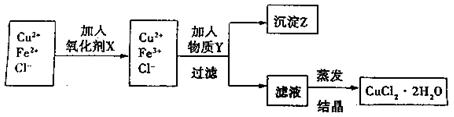
(12分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2
II.对I中所得到的溶液按下列步骤进行提纯
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是 。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
②写出沉淀Z在水中的沉淀溶解平衡方程式:
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取
的措施是 。
(4)①某同学利用反应:Cu+2H+===Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(5)已知一些难溶物的浓度积常数如下表:
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)①NaOH ②FeS ③Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com