
【题目】实验小组探究碳与浓硝酸的反应,进行下表中的实验:
实验操作 | 实验现象 |
a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 | / |
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)能证明浓硝酸表现氧化性的实验现象是___。
(2)反应产生的热量会使少量浓硝酸发生分解反应,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是___。
(3)实验现象中液面上木炭迅速燃烧,发出光亮。甲同学认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验验证猜想。
Ⅰ.制取NO2气体

①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
②NaOH溶液的作用是处理尾气,该反应生成两种物质的量相等的正盐,反应的化学方程式为___。
Ⅱ.木炭在NO2气体中燃烧。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式___。
②分析是否需要增加带火焰的木炭与纯净的X气体反应的实验并说明理由:___。
③由上述实验推断“液面上木炭迅速燃烧,发出光亮”的现象产生的原因为:___。
【答案】有大量红棕色气体生成 O2 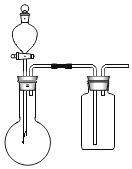 2NO2+2NaOH=NaNO2+NaNO3+H2O 2NO2+2C
2NO2+2NaOH=NaNO2+NaNO3+H2O 2NO2+2C![]() N2+2CO2 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验 主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应
N2+2CO2 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验 主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应
【解析】
(1)碳与浓硝酸的反应中,碳被氧化为二氧化碳,浓硝酸中的氮被还原为二氧化氮,据此推断,浓硝酸被还原为二氧化氮红棕色气体;
(2)浓硝酸受热分解,产生红棕色气体应为二氧化氮,根据氧化还原反应的原理可知,氮的化合价降低,则氧的化合价升高,结合产生一种无色无味的单质气体可知该气体为氧气,据此答题;
(3)|①铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图;NaOH溶液与NO2反应生成两种物质的量相等的正盐为硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式;
II.①木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式;
②木炭在NO2气体中持续燃烧,火焰迅速变亮,本身就能说明碳与NO2气体能发生反应,另外在反应过程中体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,据此答题;
③液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面.上方均存在,据此答题。
(1)碳与浓硝酸的反应中,碳被氧化为二氧化碳,浓硝酸中的氮被还原为二氧化氮,能证明浓硝酸表现氧化性的实验现象是,有大量红棕色气体生成,故答案为:有大量红棕色气体生成;
(2)浓硝酸受热分解,产生红棕色气体应为二氧化氮,根据氧化还原反应的原理可知,氮的化合价降低,则氧的化合价升高,结合产生一种无色无味的单质气体可知该气体为氧气,故答案为:O2;
(3)Ⅰ![]() 铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图为
铜与浓硝酸反应为固体和液体的反应,不需要加热,生成的NO2的能和水反应,密度比空气大,所以要用向上排空气法收集,据此可画出装置图为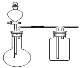 ,NaOH溶液的作用是吸收多余的NO2,NaOH溶液与NO2反应生成两种物质的量相等的正盐硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
,NaOH溶液的作用是吸收多余的NO2,NaOH溶液与NO2反应生成两种物质的量相等的正盐硝酸钠和亚硝酸钠,根据氧化还原反应的原理结合元素守恒可写出化学方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
故答案为: ;2NO2+2NaOH=NaNO2+NaNO3+H2O;
;2NO2+2NaOH=NaNO2+NaNO3+H2O;
Ⅱ![]() 木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式为:2NO2+2C
木炭在NO2气体中燃,结合元素守恒分析,产生的气体能使澄清石灰水变浑浊则为二氧化碳,另一种无色气体且遇空气不变色,则为氮气;据此写出化学方程式为:2NO2+2C![]() N2+2CO2,故答案为:2NO2+2C
N2+2CO2,故答案为:2NO2+2C![]() N2+2CO2;
N2+2CO2;
![]() 因为在反应过程中体系中有NO2气体存在,所以氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,
因为在反应过程中体系中有NO2气体存在,所以氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验,
故答案为:当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧中燃烧的实验;
![]() 液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面上方均存在,
液面上木炭迅速燃烧,发出光亮,结合后面的对比实验可以看出,碳主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体在液面上方均存在,
故答案为:主要是NO2具有助燃性,使木炭燃烧,同时也会发生与氧气的燃烧反应。


科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
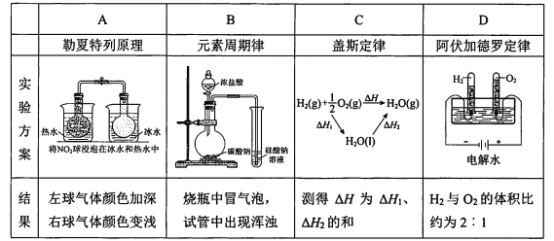
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。

①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒.其中
六种微粒.其中![]() 的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
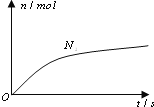
A.反应后溶液的酸性明显增强
B.消耗1mol还原剂,转移6mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.该反应的还原剂是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)反应中浓硫酸的作用是①___________________;②__________________________。
(3)实验中应缓慢加热,理由是__________________________________________________。
(4)试管II中的导管口为什么要在液面之上? _________________________________________。
(5)饱和的Na2CO3溶液的主要作用是 ______________
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份____________________,如果乙醇含有水份,如何将其转变为无水乙醇__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学角度分析,下列叙述不正确的是( )
A.银氨溶液或新制Cu (OH)2均能检验糖尿病人尿液中的葡萄糖
B.在燃煤中加入适量生石灰,可以减少二氧化硫的排放
C.铜制品在潮湿环境中的腐蚀比干燥环境中快
D.生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如下所示:![]() 纳米四氧化三铁,下列有关叙述错误的是( )
纳米四氧化三铁,下列有关叙述错误的是( )
A.纳米四氧化三铁可分散在水中形成胶体,它与![]() 溶液的分散质直径相当
溶液的分散质直径相当
B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C.在反应①中环丙胺的作用可能是促进![]() 转化为
转化为![]()
D.反应②的化学方程式是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com