
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
【答案】D
【解析】
A. 若反应中没有气体参加反应,则增大压强,化学反应速率不受影响,A错误;
B. 合成氨工业中,将氨气液化分离来可以提高产率,但不能增大正反应速率,B错误;
C. 500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,则放热QkJ,实际参加反应的N2(g)小于0.5mol,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H不等于-2QkJ/mol,C错误;
2 NH3(g) △H不等于-2QkJ/mol,C错误;
D. 平衡体系:2NiO(s)![]() 2Ni(s)+O2(g)①,2CO(g)+O2(g)
2Ni(s)+O2(g)①,2CO(g)+O2(g)![]() 2CO2(g) ②,其平衡常数分别为K1和K2,(①+②)×
2CO2(g) ②,其平衡常数分别为K1和K2,(①+②)×![]() 可得NiO(s)+CO(g)
可得NiO(s)+CO(g) ![]() Ni(s)+CO2(g),则其平衡常数为
Ni(s)+CO2(g),则其平衡常数为![]() ,D正确;
,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计_______(填“合理”或“不合理”),说明理由:___________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
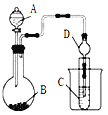
(3)仪器A的名称为_________,干燥管D的作用是________________。
(4)实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________(填写试剂名称),C中反应的离子方程式为____________________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加__________,观察到C中溶液的现象为___________________________________。有同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A.HCO3-水解方程式:HCO3-+H+![]() H2CO3
H2CO3
B.水的电离方程式:H2O+H2O![]() H3O++OH-
H3O++OH-
C.向氯化银悬浊液中滴入KI溶液:Ag++I-== AgI↓
D.甲烷的燃烧热为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为;CH4(g)+2O2=CO2(g)+2H2O(g)ΔH=-890.3 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究碳与浓硝酸的反应,进行下表中的实验:
实验操作 | 实验现象 |
a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 | / |
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)能证明浓硝酸表现氧化性的实验现象是___。
(2)反应产生的热量会使少量浓硝酸发生分解反应,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是___。
(3)实验现象中液面上木炭迅速燃烧,发出光亮。甲同学认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验验证猜想。
Ⅰ.制取NO2气体

①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
②NaOH溶液的作用是处理尾气,该反应生成两种物质的量相等的正盐,反应的化学方程式为___。
Ⅱ.木炭在NO2气体中燃烧。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式___。
②分析是否需要增加带火焰的木炭与纯净的X气体反应的实验并说明理由:___。
③由上述实验推断“液面上木炭迅速燃烧,发出光亮”的现象产生的原因为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。
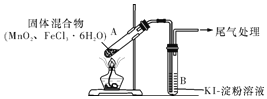
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v (丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]()
D.向CuSO4溶液中加入Na:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葛根大豆苷元![]() 用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下:
用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下:
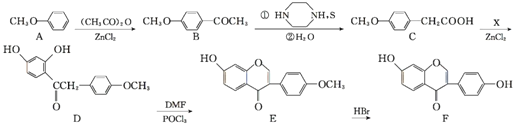
![]() 化合物B中的含氧官能团有 ______
化合物B中的含氧官能团有 ______ ![]() 填官能团名称
填官能团名称![]() ;
;
![]() 已知X为
已知X为![]() ,写出该反应的化学方程式 ______ ;
,写出该反应的化学方程式 ______ ;
![]() 已知D与
已知D与![]() 二甲基甲酰胺,结构简式为
二甲基甲酰胺,结构简式为![]()
![]() 在
在![]() 三氯氧磷
三氯氧磷![]() 的催化下反应生成E,同时还生成
的催化下反应生成E,同时还生成![]() 和另一种有机物,写出该有机物的分子式 ______ ;
和另一种有机物,写出该有机物的分子式 ______ ;
![]() 的分子式为 ______ ,由E生成F的反应类型为 ______ ;
的分子式为 ______ ,由E生成F的反应类型为 ______ ;
![]() 的芳香同分异构体中苯环上有三个取代基,并且既能发生银镜反应,又能发生水解反应的有 ______ 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 ______
的芳香同分异构体中苯环上有三个取代基,并且既能发生银镜反应,又能发生水解反应的有 ______ 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 ______ ![]() 写出其中一种的结构简式
写出其中一种的结构简式![]()
![]() 根据已有知识并结合相关信息,写出以
根据已有知识并结合相关信息,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图
的合成路线流程图![]() 无机试剂任用
无机试剂任用![]() 合成路线流程图示例如下: ____________
合成路线流程图示例如下: ____________
![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com