
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
科目:高中化学 来源: 题型:
【题目】某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。

①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)反应中浓硫酸的作用是①___________________;②__________________________。
(3)实验中应缓慢加热,理由是__________________________________________________。
(4)试管II中的导管口为什么要在液面之上? _________________________________________。
(5)饱和的Na2CO3溶液的主要作用是 ______________
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份____________________,如果乙醇含有水份,如何将其转变为无水乙醇__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2
CH2=CH2+H2O CH2=CH2+Br2![]() BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
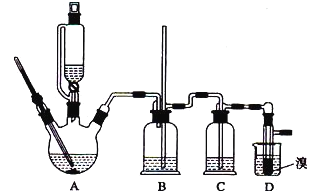
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点(℃) | 78.5 | 132 | 34.6 |
熔点(℃) | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是______。
(3)在装置c中应加入____(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是_______。
(5)将1, 2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”)。
(6)若产物中有少量未反应的Br2,最好用______(填正确选项前的字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用________的方法除去。
(8)反应过程中应用冷水冷却装置D,其主要目的是_________;但又不过度冷却(如用冰水),其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学角度分析,下列叙述不正确的是( )
A.银氨溶液或新制Cu (OH)2均能检验糖尿病人尿液中的葡萄糖
B.在燃煤中加入适量生石灰,可以减少二氧化硫的排放
C.铜制品在潮湿环境中的腐蚀比干燥环境中快
D.生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
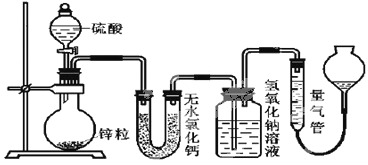
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钼![]() 、钨
、钨![]() 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
![]() 铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
![]() 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
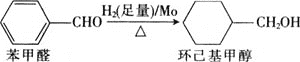
![]() 环己基甲醇分子中采取
环己基甲醇分子中采取![]() 杂化的原子是________
杂化的原子是________![]() 写元素符号
写元素符号![]() 。
。
![]() 环己基甲醇的沸点高于苯甲醛,其原因是________。
环己基甲醇的沸点高于苯甲醛,其原因是________。
![]() 铬离子
铬离子![]() 能形成多种配合物,例如
能形成多种配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,![]() 的配位数为________。
的配位数为________。
![]() 上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
![]() 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
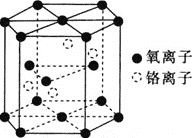
![]() 该氧化物的化学式为________。
该氧化物的化学式为________。
![]() 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm,![]() 代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为![]() 。该晶体的密度为________
。该晶体的密度为________![]() 用含a、b、
用含a、b、![]() 和M的代数式表示
和M的代数式表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com