
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
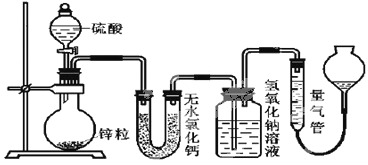
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
【答案】C Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O 得失电子守恒 ![]() 偏小 读数前使量气管左右液面相平 眼睛视线与液面最低处相平
偏小 读数前使量气管左右液面相平 眼睛视线与液面最低处相平
【解析】
分析实验装置,无水氯化钙作干燥剂,干燥生成的气体。盛有氢氧化钠溶液的试剂瓶作为洗气装置,可吸收酸性气体。结合题意,可知氢氧化钠溶液吸收SO2,而量气管主要测量生成的H2的体积。根据氢氧化钠洗气瓶的重量变化和量气瓶收集到的气体的体积进行计算,分析发生的反应。
(1)假设1.30g锌与硫酸完全反应生成氢气,即发生反应:Zn+2H+=Zn2++H2↑,根据得失电子守恒,可知生成H2的体积为V=![]() ,量气管适宜规格为500mL,C项正确;答案为:C。
,量气管适宜规格为500mL,C项正确;答案为:C。
(2)若1.30g锌粒完全溶解,生成气体的总物质的量是0.02mol,氢氧化钠能吸收二氧化硫,氢氧化钠洗气瓶增重l.28g,说明反应生成二氧化硫1.28g,则二氧化硫的物质的量=![]() ,说明反应只生成SO2气体,发生的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
,说明反应只生成SO2气体,发生的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
(3)氢氧化钠洗气瓶增重是因为吸收SO2的缘故,说明烧瓶中有SO2的生成(Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O),量气管中收集到气体是氢气,烧瓶中有氢气产生(Zn+2H+=Zn2++H2↑),这两个反应都是氧化还原反应,根据得失电子数目守恒有:![]() ,故依据的原理是得失电子守恒。答案为:得失电子守恒;
,故依据的原理是得失电子守恒。答案为:得失电子守恒;
(4)氢氧化钠洗气瓶增重mg,说明m(SO2)=mg,则n(SO2)=![]() ,消耗硫酸的物质的量为n(H2SO4)=2n(SO2)=
,消耗硫酸的物质的量为n(H2SO4)=2n(SO2)=![]() ,因为锌有剩余,因此有(Vc-
,因为锌有剩余,因此有(Vc-![]() )mol的硫酸和锌反应产生氢气,生成氢气的物质的量为(Vc-
)mol的硫酸和锌反应产生氢气,生成氢气的物质的量为(Vc-![]() )mol,则
)mol,则![]() =
=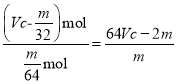 ;若撤走盛有无水氯化钙的U型管,从烧瓶中出来的水蒸气被氢氧化钠溶液吸收,m增大,则比值偏小;答案为:
;若撤走盛有无水氯化钙的U型管,从烧瓶中出来的水蒸气被氢氧化钠溶液吸收,m增大,则比值偏小;答案为:![]() ;偏小;
;偏小;
(5)因为许多反应都是放热反应,气体受温度、压强的影响,温度升高,气体受热膨胀,此时读出的气体体积偏大,因此要恢复到室温状态。为消除因压强变化导致的测量不准,可以调节量气管液面左右持平,读数时,眼睛视线与液面最低处相平,总之:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③眼睛视线与液面最低处相平。答案为:读数前使量气管左右液面相平;眼睛视线与液面最低处相平。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】25℃,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示,下列说法错误的是( )
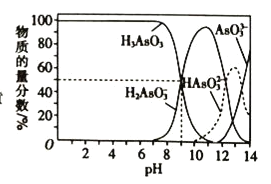
A.H3AsO3为三元弱酸,其一级电离平衡常数Ka1=10-9
B.NaH2AsO3在溶液中水解程度大于电离程度
C.pH=9的溶液中c(H+)>c(H3AsO3)= c(H2AsO3-)
D.a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如下:
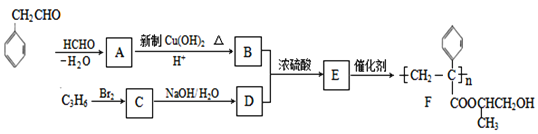
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]()
D.向CuSO4溶液中加入Na:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是___。
(2)A、B两种气体组成的混合气体8.6g,在标准状况下体积为8.96L。已知A与B的物质的量之比为3:1,相对分子质量之比为14:1,由此可推断A可能是__或__,B是__。
(3)在标准状况下,CO和CO2的混合气体质量为36g,体积为22.4L,则CO所占的体积是___L,质量是___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有________。
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是________________。
②设计1号试管实验的作用是________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__________________________。(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______________________________________________________________________。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
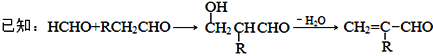
【题目】从薄荷油中得到一种烃A(C10H16),与A相关反应如下:
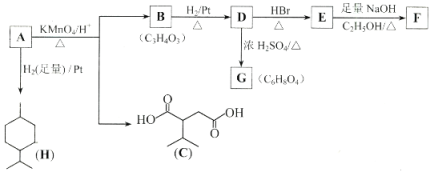
已知: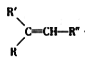
![]()
 +R
+R![]() -COOH
-COOH
![]() 所含官能团的名称为____________。
所含官能团的名称为____________。
![]() 含两个
含两个![]() 基团的C的同分异构体共有_________种
基团的C的同分异构体共有_________种![]() 不考虑手性异构
不考虑手性异构![]() ,其中核磁共振氢谱显示2个吸收峰的异构体结构简式为________。
,其中核磁共振氢谱显示2个吸收峰的异构体结构简式为________。
![]() 的反应类型为_________。
的反应类型为_________。
![]() 为含六元环的化合物,写出其结构简式________。
为含六元环的化合物,写出其结构简式________。
![]() 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为_____________。
在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为_____________。
![]() 写出
写出![]() 的化学反应方程式:________________。
的化学反应方程式:________________。
![]() 参照上述合成路线,设计由苯为原料
参照上述合成路线,设计由苯为原料![]() 无机试剂任选
无机试剂任选![]() 合成己二酸的合成路线________。
合成己二酸的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com