
【题目】25℃,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示,下列说法错误的是( )
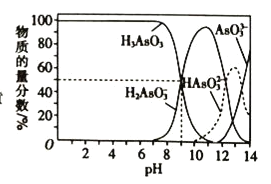
A.H3AsO3为三元弱酸,其一级电离平衡常数Ka1=10-9
B.NaH2AsO3在溶液中水解程度大于电离程度
C.pH=9的溶液中c(H+)>c(H3AsO3)= c(H2AsO3-)
D.a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-)
【答案】C
【解析】
根据题中各种微粒的物质的量分数随pH的变化曲线可知,本题考查盐类水解中粒子大小的比较,运用水解是微弱的原理分析。
A. pH=9时,溶液中存在H3AsO3![]() H2AsO3-+H+,此时
H2AsO3-+H+,此时![]() =
=![]() mol/L,
mol/L,![]() =
= ![]() ,则
,则 ![]() ,A项正确;
,A项正确;
B. 由图可知NaH2AsO3溶液显碱性,以水解为主,由此可知NaH2AsO3在溶液中水解程度大于电离程度,B项正确;
C. 由图可知pH=9的溶液中,c(H3AsO3)= c(H2AsO3-),此时溶液显碱性,则c(OH-)>c(H+),但不确定c(H+)>c(H3AsO3)= c(H2AsO3-),C项错误;
D. a点时,由图可知溶液中H2AsO3-物质的量分数最高,而H3AsO3和HAsO32-的物质的量分数相等且远小于H2AsO3-,因此a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-),D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 n![]() 是阿伏加德罗常数的数值,下列说法正确的是
是阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,![]() 克 HCl溶于水后溶液中含有 N
克 HCl溶于水后溶液中含有 N![]() 个HCl分子
个HCl分子![]()
B.标准状况下,![]() 和
和![]() 混合气体含有 N
混合气体含有 N![]() 个氧原子
个氧原子
C.![]() 的
的![]() 溶液中含有阴离子大于
溶液中含有阴离子大于![]() N
N![]() 个
个
D.![]() 与足量Fe反应,转移的电子数为3 N
与足量Fe反应,转移的电子数为3 N![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。

①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)反应中浓硫酸的作用是①___________________;②__________________________。
(3)实验中应缓慢加热,理由是__________________________________________________。
(4)试管II中的导管口为什么要在液面之上? _________________________________________。
(5)饱和的Na2CO3溶液的主要作用是 ______________
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份____________________,如果乙醇含有水份,如何将其转变为无水乙醇__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
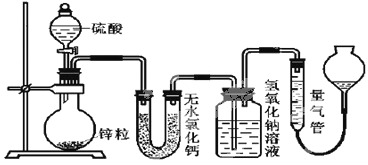
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com