
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
【答案】64g/mol 0.2mol/L 2.24L 0.2NA
【解析】
(1)先求出标况下672mL气体的物质的量,再利用质量1.92g求出该气体的摩尔质量。
(2)先利用Fe3+的质量22.4g求出Fe3+的物质的量,再除以体积,便得出溶液中Fe3+的物质的量浓度。
(3)先求出4.4g CO2气体的物质的量,再乘以22.4L/mol,便求出标准状况下体积;再乘以分子中所含的氧原子数,即得氧原子的个数。
(1)标况下672mL气体的物质的量n=![]() =0.03mol,再利用质量1.92g求出该气体的摩尔质量M=
=0.03mol,再利用质量1.92g求出该气体的摩尔质量M=![]() =64g/mol。答案为:64g/mol;
=64g/mol。答案为:64g/mol;
(2) Fe3+的物质的量n=![]() =0.4mol,溶液中Fe3+的物质的量浓度以c(Fe3+)=
=0.4mol,溶液中Fe3+的物质的量浓度以c(Fe3+)=![]() =0.2mol/L。答案为:0.2mol/L;
=0.2mol/L。答案为:0.2mol/L;
(3)4.4g CO2气体的物质的量n=![]() =0.1mol,标准状况下体积V=0.1mol×22.4L/mol=2.24L;氧原子的个数为0.1mol×2×NAmol-1=0.2NA。答案为:2.24L;0.2NA。
=0.1mol,标准状况下体积V=0.1mol×22.4L/mol=2.24L;氧原子的个数为0.1mol×2×NAmol-1=0.2NA。答案为:2.24L;0.2NA。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
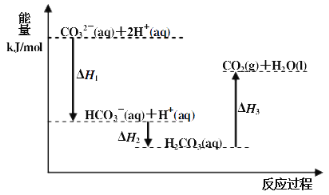
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的 | 测定 |
B | 将一定量 | 配制一定物质的量浓度的 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.杂化轨道只用于形成![]() 键或用于容纳未参与成键的孤电子对
键或用于容纳未参与成键的孤电子对
B.凡是中心原子采取![]() 杂化轨道成键的分子,其几何构型都是正四面体形
杂化轨道成键的分子,其几何构型都是正四面体形
C.CH2=CH2分子中共有四个σ键和一个π键
D.若把H2S分子写成H3S分子,违背了共价键的方向性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示,下列说法错误的是( )
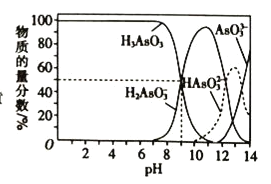
A.H3AsO3为三元弱酸,其一级电离平衡常数Ka1=10-9
B.NaH2AsO3在溶液中水解程度大于电离程度
C.pH=9的溶液中c(H+)>c(H3AsO3)= c(H2AsO3-)
D.a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
物质 | 相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置a、b的名称分别是__、__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填字母)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是__(填字母)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,下列说法中正确的是
2ClO2+2NaHSO4,下列说法中正确的是
A. NaClO3在反应中失去电子
B. SO2在反应中被氧化
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是___。
(2)A、B两种气体组成的混合气体8.6g,在标准状况下体积为8.96L。已知A与B的物质的量之比为3:1,相对分子质量之比为14:1,由此可推断A可能是__或__,B是__。
(3)在标准状况下,CO和CO2的混合气体质量为36g,体积为22.4L,则CO所占的体积是___L,质量是___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com