
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
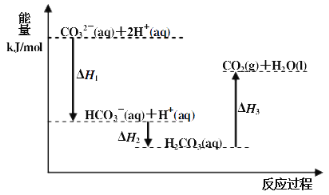
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
【答案】B
【解析】
由图象可知,CO32-(aq)+2H+(aq)生成HCO3-(aq)+H+(aq)以及HCO3-(aq)+H+(aq)生成H2CO3(aq)都为放热反应,H2CO3(aq)生成CO2(g)+H2O(l)为吸热反应,结合图象中能量的高低分析解答。
A.由图象可知,反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为吸热反应,故A错误;
B.由盖斯定律可知CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3),故B正确;
C.由图象可知,能量差值越大,反应热的绝对值越大,△H1、△H2都为放热反应,则△H1<△H2,故C错误;
D.加入催化剂,反应热不变,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是![]()
A.铝片放入NaOH溶液中有气体产生:![]()
B.泡沫灭火器灭火的原理:![]()
C.氨水吸收少量![]() 防止污染空气:
防止污染空气:![]()
D.“84”消毒液中滴少量白醋可增强漂白性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
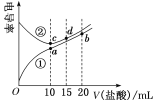
A.曲线②代表滴定二甲胺溶液的曲线
B.a点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C.d点溶液中:2c(Na+)=3c(Cl-)
D.在相同温度下,a、b、c、d四点的溶液中,水的电离程度最大的是c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯可用于合成应用广泛的DAP树脂单体和聚碳酸酯。下列反应流程中的反应条件和部分副产物已省略。
已知:Ⅰ.RCOOR′+R″OH→RCOOR″+R′OH(R、R′、R″代表烃基)
Ⅱ.
III.生成D与F的过程中,两种反应物的比值不相同
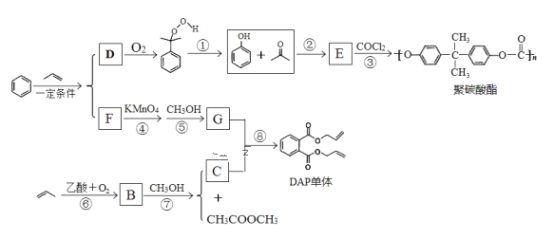
请回答下列问题:
(1)聚碳酸酯的分子式为_______________;反应③的反应类型________________。
(2)E的结构简式______________;B中所含官能团的名称是___________。
(3)下列说法正确的是_______。
a.C能发生聚合反应、加成反应和酯化反应
b.E能与FeCl3溶液发生显色反应,易溶于乙醇
c.D能与溴水发生化学反应而使溴水褪色,也能使酸性高锰酸溶液褪色
d.COCl2与![]() 结构相似,两种物质的所有原子均共平面
结构相似,两种物质的所有原子均共平面
(4)写出反应⑧的化学方程式_________________。
(5)写出同时符合下列条件的乙酸苯酚酯的所有同分异构体的结构简式_________________两种即可)。
ⅰ.能发生银镜反应;ⅱ.苯环上的一氯代物有两种。
(6)聚酯纤维是目前产量最高的一种合成纤维,其化学名称为聚对苯二甲酸乙二酯,请设计以乙烯和苯为原料 制备该树脂的合成路线,用流程图表示,无机试剂任选,注明试剂和反应条件。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
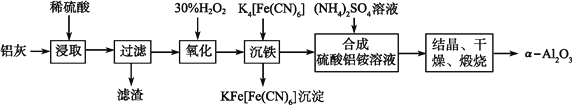
(1)写出铝灰与硫酸反应涉及的离子方程式_____________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为_________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
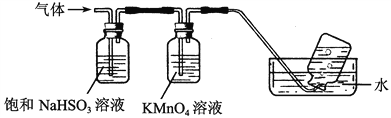
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生的离子反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com