
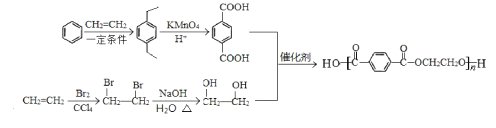
【题目】丙烯可用于合成应用广泛的DAP树脂单体和聚碳酸酯。下列反应流程中的反应条件和部分副产物已省略。
已知:Ⅰ.RCOOR′+R″OH→RCOOR″+R′OH(R、R′、R″代表烃基)
Ⅱ.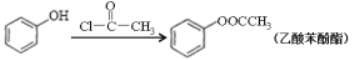
III.生成D与F的过程中,两种反应物的比值不相同
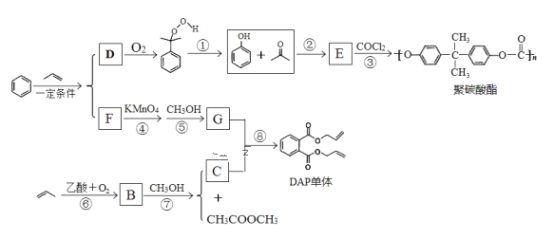
请回答下列问题:
(1)聚碳酸酯的分子式为_______________;反应③的反应类型________________。
(2)E的结构简式______________;B中所含官能团的名称是___________。
(3)下列说法正确的是_______。
a.C能发生聚合反应、加成反应和酯化反应
b.E能与FeCl3溶液发生显色反应,易溶于乙醇
c.D能与溴水发生化学反应而使溴水褪色,也能使酸性高锰酸溶液褪色
d.COCl2与![]() 结构相似,两种物质的所有原子均共平面
结构相似,两种物质的所有原子均共平面
(4)写出反应⑧的化学方程式_________________。
(5)写出同时符合下列条件的乙酸苯酚酯的所有同分异构体的结构简式_________________两种即可)。
ⅰ.能发生银镜反应;ⅱ.苯环上的一氯代物有两种。
(6)聚酯纤维是目前产量最高的一种合成纤维,其化学名称为聚对苯二甲酸乙二酯,请设计以乙烯和苯为原料 制备该树脂的合成路线,用流程图表示,无机试剂任选,注明试剂和反应条件。__________________
【答案】(C16H14O3)n 缩聚反应 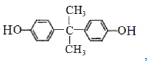 酯基,碳碳双键 ab
酯基,碳碳双键 ab 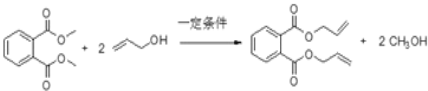
【解析】
根据题意可知,本题考查丙烯用于合成DAP树脂单体和聚碳酸酯的工艺流程,运用有机物官能团的互相转换关系及有机物的性质分析。
(1)由题意知聚碳酸酯的分子式为(C16H14O3)n,反应③为E和COCl2缩聚成聚碳酸酯,
故答案为:(C16H14O3)n;缩聚反应;
(2)反应③为E和COCl2缩聚成聚碳酸酯,由此可以逆推出E的结构简式为 ,B和甲醇反应生成C(丙烯醇)和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,则B中所含官能团的名称是酯基,碳碳双键;
,B和甲醇反应生成C(丙烯醇)和乙酸甲酯,则B的结构简式为CH3COOCH2CH=CH2,则B中所含官能团的名称是酯基,碳碳双键;
故答案为: ;酯基,碳碳双键;
;酯基,碳碳双键;
(3)a.C为丙烯醇,含有碳碳双键和羟基,碳碳双键可发生聚合反应,加成反应,羟基可发生酯化反应,故a正确;
b.E为 ,含有酚羟基,能与FeCl3溶液发生显色反应,易溶于乙醇,故b正确;
,含有酚羟基,能与FeCl3溶液发生显色反应,易溶于乙醇,故b正确;
c.由 可以推出,D中含有苯环和醛基,苯环和醛基都不能与溴水发生化学反应而使溴水褪色,故c错误;
可以推出,D中含有苯环和醛基,苯环和醛基都不能与溴水发生化学反应而使溴水褪色,故c错误;
d.COCl2与![]() 结构相似,但
结构相似,但![]() 结构中有2个饱和碳原子,结构与甲烷相似,因此所有原子不可能共平面,故d错误;
结构中有2个饱和碳原子,结构与甲烷相似,因此所有原子不可能共平面,故d错误;
故答案为:ab;
(4)D和C发生取代反应生成甲醇和DAP树脂单体,反应方程式为: ,
,
故答案为: ;
;
(5)同时符合能发生银镜反应,苯环上的一氯代物有两种的乙酸苯酚酯的同分异构体一定有醛基,且苯环上只有2种等效氢,则符合的结构简式为: ,
,
故答案为: ;
;
(6)以乙烯和苯为原料制备聚对苯二甲酸乙二酯的合成路线可为: ,
,
故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
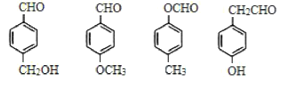
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I .CaSO4(s)+2C(s)=CaS(s) +2CO2(g) H1=+226kJ·mol—1
II.3CaSO4 (s)+CaS(s)=4CaO(s) +4SO2(g) H2=akJ·mol—1
III. 3CaS(s)+CaSO4 (s) =4CaO(s) +4S(s) H3=bkJ·mol—1
①反应(I)能在______(填“低温”“高温”或“任何温度”)下自发进行。
②用硫磺还原CaSO,反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2 (g),其△H=___ kJ·mol—1(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3![]() CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=________[已知:Ksp (CaCO3)=2. 5×10—9,Ksp(CaSO4)=3. 2×10—7],为了提高CaSO4的平衡转化率,可采取的措施是_______________________________。(写一条)。
(3)一氧化碳还原CaSO4可发生下列反应,其lgKp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。
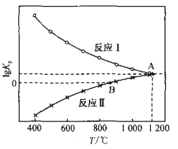
I .SO2(g)+3CO(g) ![]() 2CO2(g)+COS(g)
2CO2(g)+COS(g)
II .CaSO4(s)+CO(g) ![]() CaO(s)+CO2 (g)+SO2(g)
CaO(s)+CO2 (g)+SO2(g)
①△H>0的反应是_______(填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p (COS) =_____
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是___________(填字母)。
a. 2v(CO) 正=3v(CO2)正
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d. ![]() 的值不再随时间而变化
的值不再随时间而变化
④若在1.0 L的恒容密闭容器中加入1mol CaSO4,并充入1molCO,只发生反应II。在B点时气体总压强为1 MPa,则此时CaSO4转化率为________(已知![]() 1.41).
1.41).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
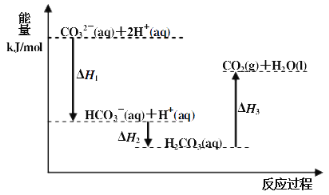
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g) +![]() O2(g) = H2O(l)△H = -285.8 kJ / mol
O2(g) = H2O(l)△H = -285.8 kJ / mol
②C(s) + O2(g) = CO2(g)△H = -393.5 kJ / mol
③C(s) + H2O(g) = CO(g) + H2(g)△H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是______(填序号,下同),属于吸热反应的是____。
(2)1 mol H2完全燃烧生成液态水,放出的热量为____kJ。
(3)写出下列反应的热化学方程式
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量;
_______________________________________________
②2 molCu(s) 与适量O2(g)反应生成CuO(s),放出314 kJ热量;
_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
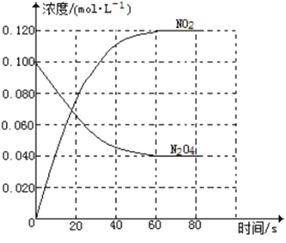
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
物质 | 相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置a、b的名称分别是__、__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填字母)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是__(填字母)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com