
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

【答案】1s22s22p3 1 +1 大 4 sp2 共价 ![]() ×100%
×100%
【解析】
(1)根据N、Ga的原子序数,结合原子构造原理分析解答;
(2)根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随着原子序数增大,电负性增强,同主族元素随着原子序数增大,电负性增强;根据同一周期元素的电负性变化规律分析比较;
(3)一个Ga与4个O相连,据此判断配位数;
(4)利用价层电子对互斥模型判断原子杂化方式;
(5)GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,通过计算晶胞体积、晶胞中As、Ga的总体积就可计算出原子的体积占晶胞体积的百分率。
(1)N是7号元素,核外电子排布式是1s22s22p3,Ga是31号元素,位于第四周期第IIIA,核外电子排布式是[Ar]3d104s24p1,应用一个轨道最多可容纳2个自旋方向相反的电子,所以在3d、4s轨道上电子成对,只有4p电子是成单电子,故Ga原子核外有1个未成对电子;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期的元素,一般情况下,同一周期的元素,原子序数越大,元素的非金属性越强,其电负性越大,所有电负性As>Ga;
(3)一个Ga与4个O相连,所以Ga的配位数为4;
(4) (CH3)3Ga中Ga形成3个δ键,没有孤电子对,所有Ga原子的杂化方式为sp2杂化;
(5) GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,As:8×![]() +6×
+6×![]() =4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=
=4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=![]() g,所以晶胞的体积V=
g,所以晶胞的体积V=![]() cm3;4个Ga原子的体积为V(Ga)=
cm3;4个Ga原子的体积为V(Ga)=![]() cm3;4个As原子的体积为V(As)=
cm3;4个As原子的体积为V(As)=![]() cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为
cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为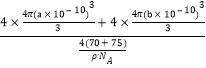 ×100%=
×100%=![]() ×100%。
×100%。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=_________,该反应在_______下能自发进行(填写:高温或低温或任意温度)
2CO2(g)+N2(g) ΔH=_________,该反应在_______下能自发进行(填写:高温或低温或任意温度)
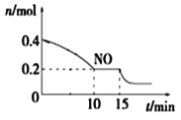
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。

已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:______________________________
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 风力、化石燃料、太阳能都是一次能源B. 需要加热才能发生的反应都是吸热反应
C. 断开1molC-H键要放出一定的能量D. 燃煤发电是将化学能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)反应②:H2(g)+CuO(s) Cu(s)+H2O(g),二者在温度T下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A. 反应①的平衡常数K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B. 反应③的平衡常数K=K1K2。
C. 对于反应③,恒容时,温度升高,K值减小,则正反应△H<0
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠( NaBiO3 )是一种难溶于水的强氧化剂,在钢铁工业中常用作锰元素的分析测定。某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3,SiO2等杂质)制备铋酸钠,其流程如下:

请回答下列问题:
(1)为了提高“浸取”中原料的浸出率,可以采取的措施是_________________(写一种即可) 。
(2)“浸取”时通常加入FeCl3溶液和浓盐酸,向其中加入过量浓盐酸的目的是_____,“滤渣”的成份是____________(填化学式)。
(3)“沉淀”反应的离子方程式为__________________________________________________;
(4)“沉淀”操作时,用氨水调节pH至6,通过计算说明,此时溶液中的Bi3+是否完全沉淀:____________________(已知:Bi(OH)3的溶度积Ksp=3×10-32) 。
(5)“焙烧”除了采用最佳的质量比、合适的温度外,你认为还需要控制的条件是________。
(6)已知,在酸性溶液中NaBiO3将Mn2+氧化为MnO4-。请出该反应的离子方程式:__________。
(7)某辉铋矿中铋元素的质量分数为20.90%,若100吨该辉铋矿完全用于生产,共得到25.00吨NaBiO3,则产率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用如下图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置。(提示:Cl2可与KI反应生成I2,I2遇淀粉变蓝)

(1)仪器连接时,各接口的顺序是(填字母代号):A接____、__接__;B接__、__接__。
(2)证明产物Cl2的实验现象是_____________。
(3)实验测得产生的氢气体积(已折算成标准状况)为11.2mL,电解后溶液的体积恰好为50.0mL,则溶液中NaOH的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)2ClNO(g) 平衡常数为K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常数为K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
(2)若反应①在温度T下达到平衡时,平衡常数为K1,升高温度后K1增大,则正反应的焓变△H____0(填“>”、“<”或“=”)。若平衡后在其他条件不变的情况下,充入少量Cl2,Cl2的转化率___________(填“变大”、“变小”或“不变”,下同),![]() 的值___________。
的值___________。
Ⅱ.近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)![]() CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。

A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的名称为__________________________;五种元素的原子半径从大到小的顺序为______________________________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,工业合成A的化学方程式为______________________________,B的结构式为_____________________。在标准状况下,将A充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,(假设溶质不扩散)最后烧瓶内溶液中溶质的物质的量浓度为________(精确到0.001)。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应水化物的化学式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com