
【题目】铋酸钠( NaBiO3 )是一种难溶于水的强氧化剂,在钢铁工业中常用作锰元素的分析测定。某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3,SiO2等杂质)制备铋酸钠,其流程如下:

请回答下列问题:
(1)为了提高“浸取”中原料的浸出率,可以采取的措施是_________________(写一种即可) 。
(2)“浸取”时通常加入FeCl3溶液和浓盐酸,向其中加入过量浓盐酸的目的是_____,“滤渣”的成份是____________(填化学式)。
(3)“沉淀”反应的离子方程式为__________________________________________________;
(4)“沉淀”操作时,用氨水调节pH至6,通过计算说明,此时溶液中的Bi3+是否完全沉淀:____________________(已知:Bi(OH)3的溶度积Ksp=3×10-32) 。
(5)“焙烧”除了采用最佳的质量比、合适的温度外,你认为还需要控制的条件是________。
(6)已知,在酸性溶液中NaBiO3将Mn2+氧化为MnO4-。请出该反应的离子方程式:__________。
(7)某辉铋矿中铋元素的质量分数为20.90%,若100吨该辉铋矿完全用于生产,共得到25.00吨NaBiO3,则产率是___________。
【答案】将矿石粉碎(或适当提高温度或增大FeCl3溶液的浓度) 防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率 SiO2 S Bi3+ + 3NH3H2O==Bi(OH)3↓+3NH4+ 当pH=6时,溶液中c(OH-)=1×10-8 molL-1此时溶液中c(Bi3+)=Ksp[Bi(OH)3]/c3(OH-)=3×10-32/(1×10-8)3=3×10-8 molL-1 由于溶液中c(Bi3+)<1×10-5 molL-1,说明Bi3+已经完全沉淀 控制干燥且无CO2的环境 5NaBiO3+2Mn2++14H+==2MnO4-+5Na++5Bi3++7H2O 89.29%
【解析】
(1)提高浸取率的措施可以是将矿石粉碎(或适当提高温度或增大FeCl3溶液的浓度)等;
(2)“浸取”时通常加入FeCl3溶液和浓盐酸,向其中加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率,二氧化硅不溶于盐酸,且铁离子将硫离子氧化产生的硫单质不溶于酸,故“滤渣”的成份是SiO2 、S;
(3)“沉淀”反应是利用氨水将Bi3+转化为沉淀,同时生成铵盐,反应的离子方程式为Bi3+ + 3NH3H2O==Bi(OH)3↓+3NH4+;
(4)“沉淀”操作时,用氨水调节pH至6,c(OH-)=10-8mol/L,c(Bi3+)=![]() =
=![]() =3×10-8 mol/L <10-5 mol/L,此时溶液中的Bi3+已完全沉淀;
=3×10-8 mol/L <10-5 mol/L,此时溶液中的Bi3+已完全沉淀;
(5)“焙烧”除了采用最佳的质量比、合适的温度外,还需要控制控制干燥且无CO2的环境;
(6)已知,在酸性溶液中NaBiO3将Mn2+氧化为MnO4-,本身被还原为Bi3+,转移电子数为10电子 ,根据氧化还原反应原理配平得,反应的离子方程式为:5NaBiO3+2Mn2++14H+==2MnO4-+5Na++5Bi3++7H2O;
(7)某辉铋矿中铋元素的质量分数为20.90%,若100吨该辉铋矿完全用于生产,共得到25.00吨NaBiO3,则产率是![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g) 已达平衡标志的是
C(g)+D(g) 已达平衡标志的是
A. 混合气体的压强 B. 混合气体的密度
C. B物质的分子量 D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
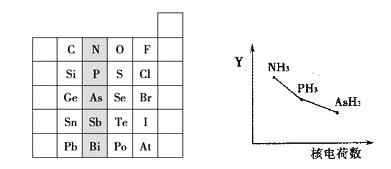
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法中,不正确的是
A. 18g H218O与D2O的混合物中,中子数为9NA
B. 标准状况下,22.4 L Cl2与NaOH溶液完全反应时转移电子的数为NA
C. 1L0.1 mol L-1NH4NO3溶液中加稀氨水,溶液呈中性时NH![]() 数为0.1NA
数为0.1NA
D. 4.6 gC2H6O中含有的C—H数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2溶液与氯气反应的离子方程式正确的是( )
A.2Fe2++Cl2=2Fe3++2Cl-
B.2FeCl2+Cl2=2FeCl3
C.Fe2++Cl2=Fe3++2Cl-
D.FeCl2+Cl2=FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、硫酸盐以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
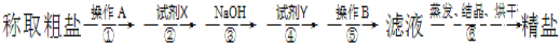
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)判断试剂X过量的方法是________________________。
(3)写出第④步中涉及反应的化学方程式____________________。
(4)第⑤步操作中得到的固体成分有:泥沙、CaCO3、Mg(OH)2、__________(填化学式)。
(5)此实验方案尚需完善,具体步骤是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备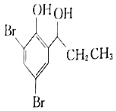 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com