
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的名称为__________________________;五种元素的原子半径从大到小的顺序为______________________________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,工业合成A的化学方程式为______________________________,B的结构式为_____________________。在标准状况下,将A充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,(假设溶质不扩散)最后烧瓶内溶液中溶质的物质的量浓度为________(精确到0.001)。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应水化物的化学式为__________________。
【答案】氧 Al>C>N>O>H N2+3H2![]() 2NH3
2NH3 ![]() 0.045 mol/L H2SeO4
0.045 mol/L H2SeO4
【解析】
组成蛋白质的基础元素是C、H、O、N,地壳中含量最高的金属元素是Al。因为X、Y、Z、L、M五种元素的原子序数依次增大,则X为H,Y为C,Z为N,L为O,M为Al。
(1) 根据以上分析,L为O,L的名称为氧;同周期元素原子半径从左到右依次减小,随着周期数增大,原子半径逐渐增大,因此原子半径从大到小的顺序为Al>C>N>O>H。
故答案为:氧;Al>C>N>O>H;
(2) A为NH3,工业上在高温高压催化剂的条件下合成NH3,化学方程式为N2+3H2![]() 2NH3;B为N2H4, 结构式为
2NH3;B为N2H4, 结构式为![]() ;
;
设烧瓶的容积为VL,则标准状况下VL氨气溶于水形成氨水充满整个烧瓶,最后烧瓶内溶液中溶质的物质的量浓度为![]() =0.045mol/L。
=0.045mol/L。
故答案为:N2+3H2![]() 2NH3;
2NH3;![]() ;0.045mol/L;
;0.045mol/L;
(3) O为第ⅥA族,该族元素最高价为+6价(除去O),则Se的最高价氧化物对应水化物为H2SeO4;
故答案为:H2SeO4。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/|LCH3COONa 与0.lmol/LHCl 溶液等体积混合: c(Na+)=c(Cl-)>c(OH-)>cCH3COO-)
B. 0.lmol/LNH4Cl与0.lmol/L 氨水等体积浪合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3与0.lmol/LNaHCO3溶液等体积混合:2/3c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4与0.lmol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应m A(g)+n B(g)![]() p C(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则:
p C(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则:
(1)该反应的逆反应是______热反应,且p ______ m+n (填“>”、“<”或“=”)。
(2)其他条件不变时,增大压强,C的质量分数______,逆反应速率______。(填“增大”、“减小”或“不变”)
(3)其他条件不变时,若加入B(体积不变),则A的转化率______。(填“增大”、“减小”或“不变”)
(4)其他条件不变时,若降低温度,则平衡时B、C的浓度之比c(C)/c(B)比值将______。(填“增大”、“减小”或“不变”)
(5)其他条件不变时,若加入催化剂,该反应的反应热______。(填“增大”、“减小”或“不变”)
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色______。(填“变浅”、“变深”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备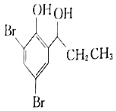 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年政府工作报告提出要持续开展大气污染的治理攻坚。下列不属于大气污染防治措施的是
A.  向酸性土壤中加入熟石灰
向酸性土壤中加入熟石灰
B.  汽车尾气净化减排
汽车尾气净化减排
C.  工业尾气回收处理
工业尾气回收处理
D.  用清洁能源替代化石燃料
用清洁能源替代化石燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com