
【题目】从化学角度分析,下列叙述不正确的是( )
A.银氨溶液或新制Cu (OH)2均能检验糖尿病人尿液中的葡萄糖
B.在燃煤中加入适量生石灰,可以减少二氧化硫的排放
C.铜制品在潮湿环境中的腐蚀比干燥环境中快
D.生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数为NA
B.NA个CO2分子占有的体积为22.4L
C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究碳与浓硝酸的反应,进行下表中的实验:
实验操作 | 实验现象 |
a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 | / |
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)能证明浓硝酸表现氧化性的实验现象是___。
(2)反应产生的热量会使少量浓硝酸发生分解反应,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是___。
(3)实验现象中液面上木炭迅速燃烧,发出光亮。甲同学认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验验证猜想。
Ⅰ.制取NO2气体

①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
②NaOH溶液的作用是处理尾气,该反应生成两种物质的量相等的正盐,反应的化学方程式为___。
Ⅱ.木炭在NO2气体中燃烧。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式___。
②分析是否需要增加带火焰的木炭与纯净的X气体反应的实验并说明理由:___。
③由上述实验推断“液面上木炭迅速燃烧,发出光亮”的现象产生的原因为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v (丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如下:
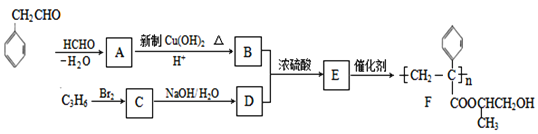
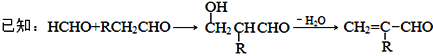
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量CO2:SiO![]() +CO2+H2O=H2SiO3↓+CO
+CO2+H2O=H2SiO3↓+CO![]()
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]()
D.向CuSO4溶液中加入Na:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有________。
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是________________。
②设计1号试管实验的作用是________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__________________________。(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______________________________________________________________________。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___和___,原因是___。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。
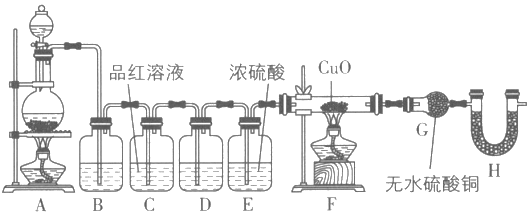
①为验证并吸收SO2,装置B中加入的试剂为___;装置C中品红溶液的作用是___。
②装置D中加入的试剂为___。
③装置G中可能出现的现象为___。
④装置H的作用为___。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
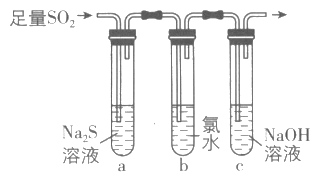
①能验证SO2具有氧化性的实验现象为___;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液加入品红溶液,红色褪去;
方案II:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案III:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___(填I、II或III);试管b中发生反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com