
【题目】下列有关化学用语表示正确的是
A.HCO3-水解方程式:HCO3-+H+![]() H2CO3
H2CO3
B.水的电离方程式:H2O+H2O![]() H3O++OH-
H3O++OH-
C.向氯化银悬浊液中滴入KI溶液:Ag++I-== AgI↓
D.甲烷的燃烧热为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为;CH4(g)+2O2=CO2(g)+2H2O(g)ΔH=-890.3 kJmol-1
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖由约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰三人分获,以表彰他们研究锂离子电池做出的贡献。锂离子正极材料有LiMO2(M=Co、Ni、Mn) .
回答下列问题:
(1)基态Co原子价电子排布式为______,基态Li原子核外电子运动状态有____种。
(2)锂离子电池电解常用的锂盐有LiClO4、LiBF4等,常采用有机溶剂有乙醚、丙烯酯(![]() )等。
)等。
①LiClO4中阴离子空间构型为______,与其键合方式相同、空间构型也相同的离子和分子是___________________________ (各举一例).
②Li、Cl、F、B的电负性从大到小的顺序为_____;丙烯碳酸酯中碳原子的杂化方式是____。
③C2H5OC2H5(乙醚)的沸点比乙醇的低,其原因是________________。
(3)LiCoO2的晶胞是六棱柱,其结构如图所示:

晶胞中含氧原子数为_____,若晶胞的底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则LiCoO2的密度为_______g·cm —3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
D. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH试纸检验,漂白液pH>7,饱和![]() 溶液pH<7。
溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出相应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。

①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式________。
③若打开分液漏斗活塞向烧瓶中加入饱和![]() 溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加
溶液,观察到产生大量的白色胶状沉淀,同时有黄绿色气体产生。A中加![]() 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒.其中
六种微粒.其中![]() 的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
的物质的量随时间变化的曲线如图所示.则下列判断正确的是( )
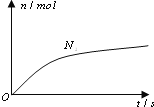
A.反应后溶液的酸性明显增强
B.消耗1mol还原剂,转移6mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.该反应的还原剂是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.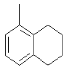 中所有的碳原子可能在同一平面上
中所有的碳原子可能在同一平面上
B.![]() 的一氯代物有4种
的一氯代物有4种
C.![]() 的命名为2,3-二甲基-1-丙醇
的命名为2,3-二甲基-1-丙醇
D.1mol![]() 与足量的NaOH溶液、溴水反应时,消耗NaOH和Br2的物质的量为4mol和2mol
与足量的NaOH溶液、溴水反应时,消耗NaOH和Br2的物质的量为4mol和2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com