
【题目】构成下列结构片断蛋白质的氨基酸的种类为( )
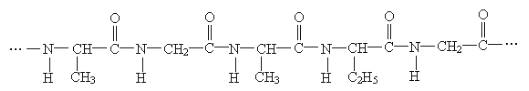
A.2种B.3种C.4种D.5种
【答案】B
【解析】
两个氨基酸分子,在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水缩合形成含有肽键的化合物,称为成肽反应,蛋白质水解断裂的是肽键,断裂碳氧双键和碳氮单键,生成相应的氨基酸,故该片断蛋白质水解生成的氨基酸的结构简式依次为:H2NCH(CH3)COOH、H2NCH2COOH、H2NCH(CH3)COOH;H2NCH(C2H5)COOH、H2NCH2COOH,可见共有3种氨基酸,答案为B。
【点晴】
蛋白质是复杂的多肽,其水解生成氨基酸,氨基酸形成多肽时是氨基脱氢、羧基脱去羟基,所以蛋白质水解,分子结构中含有的![]() 断裂碳氧双键和碳氮单键,水解得到羧基和氨基,生成相应的氨基酸。
断裂碳氧双键和碳氮单键,水解得到羧基和氨基,生成相应的氨基酸。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气和烧碱等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
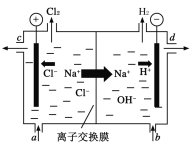
(1)电解饱和食盐水的离子方程式为___。
(2)氢氧化钠溶液从图中___(填“a”、“b”、“c”或“d”)位置流出。
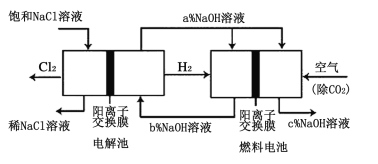
(3)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。通入氢气的电极的电极反应式为___,燃料电池中阳离子的移动方向___(“从左向右”或“从右向左”)。电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为___。a、b、c的大小关系为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法错误的是
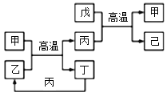
A.W的原子序数是 Z 的两倍,金属性强于Z
B.W元素在周期表中的位置是第四周期VIII族
C.己属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计_______(填“合理”或“不合理”),说明理由:___________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
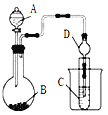
(3)仪器A的名称为_________,干燥管D的作用是________________。
(4)实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________(填写试剂名称),C中反应的离子方程式为____________________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加__________,观察到C中溶液的现象为___________________________________。有同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
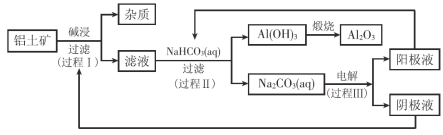
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
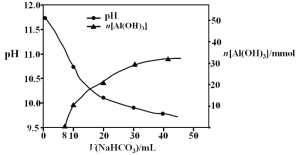
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
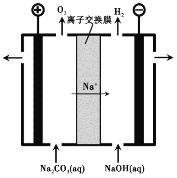
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数为NA
B.NA个CO2分子占有的体积为22.4L
C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的数值。下列说法正确的是
A.用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
B.28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个
C.0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA
D.常温下,0.1mol·L-1的碳酸钠溶液中含有的阴离子数大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A.HCO3-水解方程式:HCO3-+H+![]() H2CO3
H2CO3
B.水的电离方程式:H2O+H2O![]() H3O++OH-
H3O++OH-
C.向氯化银悬浊液中滴入KI溶液:Ag++I-== AgI↓
D.甲烷的燃烧热为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为;CH4(g)+2O2=CO2(g)+2H2O(g)ΔH=-890.3 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v (丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com