
����Ŀ���������ӷ���ʽ��ȷ����( )
A. ��������Һ������ȩ�е�ȩ����CH3CHO+2Ag(NH3)2+ +2OH�� ![]() CH3COONH4 +3NH3+2Ag��+H2O
CH3COONH4 +3NH3+2Ag��+H2O
B. ��������Һ��ͨ������CO2��CO2 +H2O+2C6H5O����2C6H5OH+CO32��
C. �������������ͭ����Һ�У�2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
D. �������е���AgNO3��Һ����������Ԫ�أ�Cl��+Ag+=AgCl��
���𰸡�C
��������
A. CH3COONH4�ǿ������Σ���������ʽ���ڣ�A����
B.��������Һ��ͨ������CO2��������Ӧ����HCO3-��B����
C.��������������������������ͭ����Һ�������ֽⷴӦ��������ͭ��ˮ�����ӷ���ʽΪ��2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O��C��ȷ��
D.�������е���Ԫ����Clԭ����ʽ���ڣ���Ҫ���飬Ӧ��ʹClԭ��ת��ΪCl-��Ȼ���ټ���AgNO3��Һ���飬D����
�ʺ���ѡ����C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ǹ�ҵ��ģ��ˮ����ij��÷������������£�
Ũ����ˮ![]() �ֲ�Ʒ��
�ֲ�Ʒ��![]() ������
������![]() ����X
����X![]() ��Ʒ��
��Ʒ��
����˵���������
A.���з�������Ҫ��ӦΪCl2��2Br����Br2��2Cl��
B.����XΪHBrO
C.�ڢ۵�Ŀ���Ǹ�����Ԫ��
D.�������������������ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������(����������������)������������Ʒ�Ĺ�ҵ�������£�
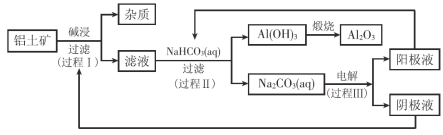
��1������I��������Ӧ�����ӷ���ʽ�� ��
��2������II����һ��Ũ�ȵ�NaHCO3��Һ�����������Һ��������ҺpH��Al(OH)3���ɵ��������NaHCO3��Һ����仯���������£�
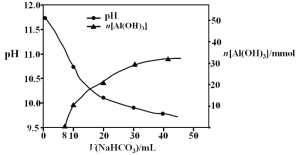
�� ����NaHCO3��Һ���С��8 mLʱ��������Ҫ��Ӧ�����ӷ���ʽ�� ��
�� ����II����Al(OH)3�����ӷ���ʽ�� ��
��3������III�����Na2CO3��Һ��װ������ͼ��ʾ��
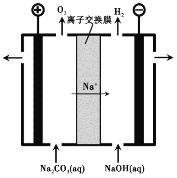
�� �����ĵ缫��Ӧʽ�� ��
�� ��������Һ���ɵ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA�ǰ����ӵ���������ֵ������˵����ȷ����
A.�ö��Ե缫���CuSO4��Һ���������0.1molCu(OH)2��ʹ��Һ��ԭ�����·��ת�Ƶ��ӵ���ĿΪ0.2NA
B.28����C3H6��C4H8��ɵĻ�������к����õ��Ӷ���ĿΪ6NA��
C.0.1mol������Ϊ�������õ����ӵ���Ŀһ��Ϊ0.4NA
D.�����£�0.1mol��L-1��̼������Һ�к��е�������������0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(SiHCl3)�ǹ����ҵ��һ�ֹؼ���ѧԭ�ϣ��Ʊ���Ӧ�ķ���ʽΪSi(s)��3HCl(g)![]() SiHCl3(g)��H2(g)��ͬʱ������������Ӧ����������Ӧ��ϵ��ѹǿΪ0.05 MPaʱ���ֱ�ı���ϱ�[n(HCl)��n(Si)]�ͷ�Ӧ�¶ȣ����߶�SiHCl3����Ӱ����ͼ��ʾ������˵����ȷ����
SiHCl3(g)��H2(g)��ͬʱ������������Ӧ����������Ӧ��ϵ��ѹǿΪ0.05 MPaʱ���ֱ�ı���ϱ�[n(HCl)��n(Si)]�ͷ�Ӧ�¶ȣ����߶�SiHCl3����Ӱ����ͼ��ʾ������˵����ȷ����
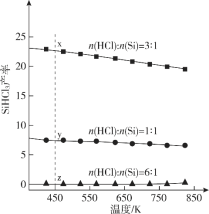
A. ����ѹǿ���������SiHCl3�IJ���
B. �Ʊ�SiHCl3�ķ�ӦΪ���ȷ�Ӧ
C. �¶�Ϊ450 K��ƽ�ⳣ����K(x)��K (y)��K (z)
D. ����HCl��������SiHCl3�IJ���һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ����
A.HCO3��ˮ�ⷽ��ʽ��HCO3����H+![]() H2CO3
H2CO3
B.ˮ�ĵ��뷽��ʽ��H2O��H2O![]() H3O+��OH��
H3O+��OH��
C.���Ȼ�������Һ�е���KI��Һ��Ag����I��== AgI��
D.�����ȼ����Ϊ-890.3 kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2=CO2��g��+2H2O��g����H��-890.3 kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A��28g���������е�ԭ����ĿΪNA
B����״���£�22.4Lˮ�к��и�ˮ����NA
C��2NA�������������NA�������������2��
D����״���£�22.4L�Ȼ���������ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͨ������װ��̽��MnO2��FeCl3��6H2O�ܷ�Ӧ����Cl2��FeCl3�������¶�Ϊ315�档
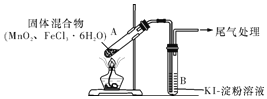
ʵ�����������
���� | ���� |
��ȼ�ƾ��ƣ����� | ��.A�в��ֹ����ܽ⣬�Ϸ����ְ��� ��.�Ժ�����ɫ���壬�ܱڸ��Ż�ɫҺ�� ��.B����Һ���� |
��1�������еİ�����___��
��2������������С��̽����ɫ����ijɷ֣�ʵ�����£�
a.����FeCl3��6H2O�����������ͻ�ɫ���塣
b.��KSCN��Һ��������a�еĻ�ɫ���壬��Һ����졣ͨ����ʵ��˵�������л�ɫ���庬��___��
��3������������ʹB����Һ�����⣬�Ʋ���ܵ�ԭ���ǣ�
��ʵ��b���������ʹ֮��������Ӧ�����ӷ���ʽ��___����ʵ��֤ʵ�Ʋ������
����Һ����������һ��ԭ���ǣ������������£�װ���еĿ���ʹ֮������ͨ����һ��ʵ��ȷ�������ֿ����ԣ���ʵ�鷽����___��
��4��Ϊ��һ��ȷ�ϻ�ɫ�����Ƿ���Cl2��С��������ַ�������֤ʵ��Cl2�Ĵ��ڡ�
����1����A��B������ʢ��ij���Լ���ϴ��ƿC��
����2����B��KI������Һ�滻ΪNaBr��Һ������Fe2+��
�������£�
����1 | B����Һ��Ϊ��ɫ |
����2 | B����Һ��dz�Ⱥ�ɫ��δ���Fe2+ |
�ٷ���1��C��ʢ�ŵ��Լ���___(����ĸ)��
A.NaCl������Һ B.NaOH��Һ C.NaClO��Һ
�ڷ���2�м���Fe2+��ԭ����___��
���ۺϷ���1��2������˵��ѡ��NaBr��Һ��������___��
��5����A�еIJ������õ�Fe2O3��MnCl2��A�в���Cl2�Ļ�ѧ����ʽ�ǣ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����̼���̿���Ҫ�ɷ�ΪMnCO3������FeO��Fe2O3��CaO�����ʣ�Ϊ��Ҫԭ����������ﮣ�LiMn2O4���Ĺ����������£�
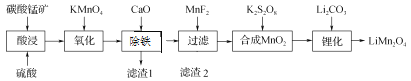
��֪���������ӳ�����pHֵ��
���� | ��ʼ������pHֵ | ������ȫʱ��pHֵ |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
��1�� Ϊ�����̼���̿��������ʣ����������ʱ�ɲ�ȡ�Ĵ�ʩ�У����ʵ������¶ȣ��ڽ��裻��_____�ȡ�
��2�� ����ʱ���������ӷ���ʽ��_________��
��3�� ����CaO����������ԭ����____________��
��4�� ����MnF2Ϊ�˳�ȥ��Һ�е�Ca2������������Һ��F��Ũ��Ϊ3��10��3 mol��L��1����Ca2����Ũ��Ϊ________mol��L��1[����ʱ��Ksp��CaF2����2.7��10��11]��
��5�� ��﮻����ǽ�MnO2��Li2CO3��4��1�����ʵ��������ϣ���ĥ3��5 h��Ȼ��������600��750 �棬����24 h����Ȼ��ȴ�����µò�Ʒ�����µ�515 ��ʱ����ʼ��CO2��������Ԥ��̼��﮵ķֽ��¶ȣ�723 �棩�͵öࡣ���ܵ�ԭ����________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com