
【题目】“低碳资源”正成为科学家研究的主要课題,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ·mol-1
①己知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
则反应:3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g)的△H=______________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分別用不同pH的吸收剤吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如下图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_________ (精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_________________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示。

①该反应的化学方程式为___________________;反应过程中碳元素的化合价为-2价的中间体是__________________________。
②向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为___________________。
③己知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是_____________(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
【答案】 +18.7kJ·mol-1 0.13mol 碳酸氢铵受热分解生成二氧化碳,氨水受热挥发 CO2+4H2![]() CH4+2H2O MgOCH2 80% CD
CH4+2H2O MgOCH2 80% CD
【解析】(1) 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ·mol-1,C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJ·mol-1,根据盖斯定律,两个热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)△H= +18.7kJ·mol-1;正确答案:+18.7kJ·mol-1。
(2) ①二氧化碳的脱除效率与氨水pH的关系为:溶液的碱性越大,吸收效率越高,故二氧化碳脱除效率随氨水pH增大而增加。30min流入氨水的体积为1/2×0.052×103=26L,根据CO2+NH3H2O=NH4HCO3反应,可知n(NH3)=n(CO2),相同条件下体积之比等于物质的量之比,则标准状况,吸收的二氧化碳的体积为26×91.6%×12%=2.86L,二氧化碳的物质的量为2.86/22.4=0.13mol;正确答案:0.13 mol。
②从40~50℃,二氧化碳脱除效率降低的原因是碳酸氢铵受热分解生成二氧化碳,氨水受热挥发;正确答案:碳酸氢铵受热分解生成二氧化碳,氨水受热挥发。
(3)①据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,反应的方程式为: CO2+4H2![]() CH4+2H2O ;反应过程中碳元素的化合价为-2价的中间体是MgOCH2 ;正确答案:CO2+4H2
CH4+2H2O ;反应过程中碳元素的化合价为-2价的中间体是MgOCH2 ;正确答案:CO2+4H2![]() CH4+2H2O ;MgOCH2 。
CH4+2H2O ;MgOCH2 。
②根据CO2+4H2![]() CH4+2H2O反应可知,甲烷的变化浓度为0.8 mol·L-1,则二氧化碳的变化浓度为0.8 mol·L-1,二氧化碳起始浓度为0.2+0.8=1 mol·L-1,CO2的平衡转化率为0.8/1×100%=80%;正确答案:80%。
CH4+2H2O反应可知,甲烷的变化浓度为0.8 mol·L-1,则二氧化碳的变化浓度为0.8 mol·L-1,二氧化碳起始浓度为0.2+0.8=1 mol·L-1,CO2的平衡转化率为0.8/1×100%=80%;正确答案:80%。
③容器Ⅰ中从正反应开始到达平衡,容器Ⅱ中从逆反应开始到达,平衡建立的途径不相同,无法比较反应速率,A错误;如果两个密闭容器为恒温恒容,两个反应达平衡后为等效平衡,CH4的物质的量分数相同;但是容器Ⅰ反应发生后,由于恒容绝热,反应放热体系温度升高,平衡左移,所以容器Ⅰ甲烷的物质的量分数大于容器Ⅱ中CH4的物质的量分数,B错误;容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,故容器Ⅰ中CO2的物质的量比容器Ⅱ中的多,C正确;温度相同时,容器I中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,故容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,D正确;正确选项CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质,请回答下列问题。
(1)碳酸氢钠的俗称是_________,其水溶液显_____性。(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式____________。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为________________________________。
(4)硫酸亚铁是缺铁性贫血的治疗药物,可用于制备铁盐,实验室检验Fe3+的方法是:向溶液中滴入几滴_________________溶液,观察溶液是否变为血红色。向FeSO4溶液中加入NaOH溶液通常得不到白色的Fe(OH)2沉淀,其原因是_________________________(用化学方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
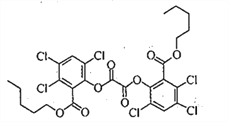
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 在常温、常压下,11.2 L N2含有的分子数为0.5NA
B. 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA
C. 18 g H2O的物质的量是1mol
D. 标况下,1 mol SO2的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( )

A. a点所得溶液中:2c(H2A)+c(A2-)=0.1mol/L
B. b点所得溶液中:2c(H2A)+c(H+)=c(A2-)+c(OH-)
C. c点所得溶液中:c(K+)<3c(HA-)
D. d点所得溶液中A2-第一级水解平衡常数为10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:
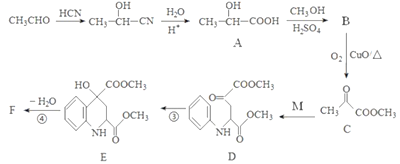
已知:M的结构简式为: 。
。
请回答下列问题:
(1)A的化学名称是______________________。
(2)C中官能团的名称是_________________________。
(3)写出F的结构简式____________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:_________________。
(5)满足下列条件的M的同分异构体有_____种(不含立体异构)。
①能够发生银镜反应。
②含有硝基(-NO2),且硝基直接连在苯环上。
③含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6:2:2:1的结构简式为______________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设某元素的原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A. 不能由此确定该元素的相对原子质量
B. 这种元素的相对原子质量为(m+n)g
C. 碳原子质量为wg,此原子的质量为(m+n)wg
D. 核内中子的总质量小于质子的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以C2H2为原料合成环丁烯类化合物L的路线如下:
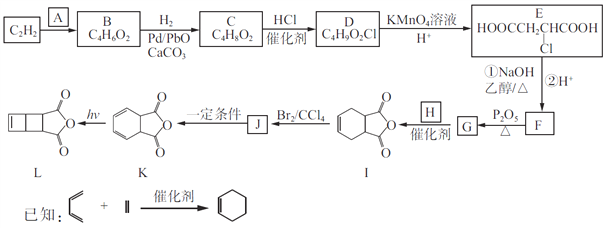
(1)A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为____________。
(2)B分子中的碳原子都在同一直线上,B的结构简式为________________。
(3)C→D、J→K的反应类型分别为________________、________________。
(4)设计C→D、E→F两步反应的目的是________________________。
(5)G和H生成I的化学方程式为______________________。
(6)化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2,X共有__种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为____________________。
(7)写出用![]() 和乙炔为原料制备
和乙炔为原料制备![]() 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明最近去医院做了体检,得到的血液化验单中标有葡萄糖5.9×10-3mol/L,正常值为3.9~6.1×10-3mol/L表示该体检指标的物理量是( )
A.物质的量(n)B.物质量的浓度(c)C.溶解度(s)D.摩尔质量(M)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com