
【题目】下列说法不正确的是( )
A. 在常温、常压下,11.2 L N2含有的分子数为0.5NA
B. 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA
C. 18 g H2O的物质的量是1mol
D. 标况下,1 mol SO2的体积是22.4 L
【答案】A
【解析】
A. 常温常压不是标准状况,在常温常压下,气体摩尔体积大于22.4 L/mol;
B. 分子个数N = ![]() ×NA;
×NA;
C. 依据n = ![]() 计算物质的量;
计算物质的量;
D. 依据V = nVm来计算气体的体积;
A. 常温常压下,气体摩尔体积大于22.4 L/mol,故11.2 L氮气的物质的量小于0.5mol,则分子个数小于0.5 NA个,故A项错误,符合题意;
B. 标况下22.4 L氧气和氢气混合气体中的分子个数N = ![]() ×NA=
×NA= ![]() ×NA/mol=NA个
×NA/mol=NA个
故B项正确,不符合题意;
C. 18 g H2O的物质的量 = ![]() = 1 mol,故C项正确,不符合题意;
= 1 mol,故C项正确,不符合题意;
D. 标况下,1 mol SO2的体积 = 1 mol×22.4 L/mol = 22.4 L,故D项正确,不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO沉淀质量,以确定碳酸钙的质量分数。
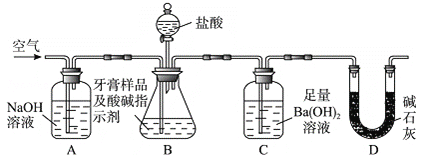
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________________。
(4)C中反应生成沉淀的离子方程式是______________________________。
(5)下列各项措施中,不能提高测定准确度的是____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气性质的微型实验装置如图所示,①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有石蕊试液、淀粉KI试液、KBr溶液、含KSCN的FeCl2几种溶液,实验时滴几滴浓盐酸,下列说法不正确的是
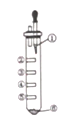
A. 产生氯气的离子方程式为:16H++10C1-+2MnO4-=2Mn2++5Cl2↑+8H2O
B. ⑤处变红色,发生反应为:2Fe2++Cl2=2Fe3++2C1-,Fe3++3SCN-=Fe(SCN)3
C. ②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性
D. ③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量和摩尔质量的叙述,正确的是 ( )
A. 水的摩尔质量是18 g
B. 0.012 kg 12C中约含有6.02![]() 1023个碳原子
1023个碳原子
C. 1 mol水中含有2 mol氢和1 mol氧
D. 1 mol任何物质都含有6.02![]() 1023个分子
1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A. X的氢化物溶于水显酸性 B. Y原子的电子排布式为1s22s22p63s2
C. Z元素在周期表中的位置为第三周期第Ⅵ族 D. X和Z的最高价氧化物对应水化物都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳资源”正成为科学家研究的主要课題,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ·mol-1
①己知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
则反应:3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g)的△H=______________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分別用不同pH的吸收剤吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如下图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_________ (精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_________________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示。

①该反应的化学方程式为___________________;反应过程中碳元素的化合价为-2价的中间体是__________________________。
②向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为___________________。
③己知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是_____________(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
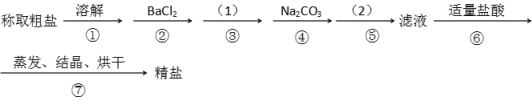
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________。
(2)实验方案的(1)中应使用除杂试剂的化学式__________,发生的离子方程式是__________,在实验方案的(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
(4)判断BaCl2已过量的方法是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前世界上用量最大的金属材料,有关铁及其化合物的说法不正确的是
A. 磁铁矿的成分是Fe3O4B. Fe3+遇KSCN溶液显红色
C. Fe可被冷的浓HNO3钝化D. Fe2+可被还原剂还原为Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com