
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.0.1mol —NH2(氨基)中含有的电子数目为1.0NA
B.常温下,1L 0.1mol·L-1 CH3COONa溶液中含有的CH3COO-和Na+总数为0.2NA
C.标准状况下,2.24 LH2O中含有的原子总数为3NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
D
【解析】
试题分析:A、1个氨基中有9个电子,所以0.1mol氨基中有0.9NA的电子,错误;B、根据物料守恒,1L 0.1mol·L-1 CH3COONa溶液中含有的CH3COOH、CH3COO-和Na+总数为0.2NA,错误;C、标准状况下,水不是气体,所以22.4L的水的物质的量不是0.1mol,含有的原子总数不是0.3NA,错误;D、氧气和臭氧都是由O原子构成的,所以16g二者的混合物中O原子数目是16g/16g/mol×NA=NA,正确,答案选D。
考点:考查阿伏伽德罗常数与微粒数的关系
考点分析: 考点1:化学计算 考点2:化学用语及其规律 试题属性

 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O =AlO2—+ 4NH4++2H2O
B.铁与稀盐酸反应: 2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化钡和稀硫酸: Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
D.将钠加入水中: Na+2H2O=Na++2OH—+H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
某实验小组用下图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:
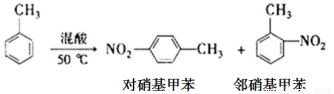
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)仪器A的名称是________。
(2)配制混酸的方法是 。
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是: 。
(4)本实验采用水浴加热,水浴加热的优点是 。
(5)分离反应后产物的方案如下:

操作1的名称是 ,操作2中不需要用到下列仪器中的 。(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为________(结果保留小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)> r(R)> r(X) > r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
用下列实验装置和方法进行相应实验,能达到实验目的的是
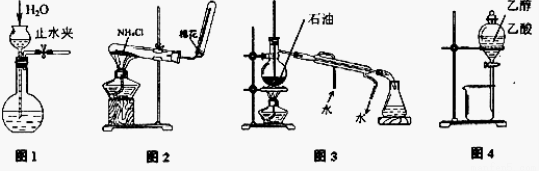
A.用图1所示方法检查装置的气密性
B.用图2所示装置和方法制取氨气
C.用图3所示装置和方法进行石油分馏
D.用图4装置和方法分离乙醇与乙酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:实验题
(15分)亚氯酸钠(NaClO2 )是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:

回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、 、 。
(2)实验须使NaClO3稍微过量,目的是 。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为 。
(5)B中反应的离子方程式为 。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入 (填序号,下同)酸化,再加入 检验。
①稀HNO3
②稀H2SO4
③K2SO3溶液
④BaCl2溶液
⑤FeCl2溶液
⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2·3H2O(式量:144.5),至少需 g NaClO3(式量:106.5)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如图,其中X元素的原子最外层电子数等于其电子层数。下列说法不正确的是
Z | W | ||
X | Y |
A.X位于元索周期表中第3 周期、ⅢA族
B.原子半径:X > Z > W
C.最简单气态氢化物的热稳定性:W > Y
D.Y的最高价氧化物可以和W的最简单氢化物反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如左上图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为
______________________________________________________________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为_________________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如右上图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:填空题
(14分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S + S b. Z + S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 == Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com