
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解所得产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物(铁的氧化物、硫的氧化物、含氮物质、水)的具体成分(已知每个装置中的药品足量)。
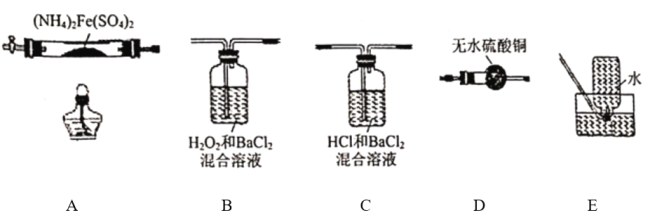
(1)利用上述装置完成该实验,则该装置的正确连接顺序为_______________(用装置下面的字母填连接顺序,每个装置都要使用)。加热A前需要通入一段时间N2目的是_______________。
(2)若观察到B中有白色沉淀生成,C中无明显现象,则装置C的作用为_______________,D中白色变为蓝色,写出B中发生反应的离子方程式_______________装置B与装置C能否互换_______________(填 “能”或“否”),原因是_______________(填“能”则不填此空)。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容(试剂,仪器和用品自选)。
实验步骤 | 预期现象 | 结论 |
_______________ | _______________ | 固本残留物仅为Fe2O3 |
(4)硫酸亚铁铵在500℃时隔绝空气加热完全分解,若E中收集到的气体只有N2,A中固体残留物Fe2O3的质量为80g,B中沉淀物质的量为2rnol,则生成N2的质量为_______________g。
(5)某含铬(Cr2O72-)废水用硫酸亚铁铵溶液滴定处理,反应后铁元素和铬元素完全转化为沉淀(沉淀中铬元素化合价为+3),该沉淀经干燥后得到amolFeOFemCrnO3,不考虑处理过程中的实际损耗,则消耗硫酸亚铁铵的物质的量为_______________mol(用a的代数式表示)。
【答案】ADCBE 实验前通入氮气是为了排除装置内的空气,防止对实验造成干扰,减少实验误差 检验生成的气体中是否有三氧化硫,并除去三氧化硫和氨气 SO2+H2O2+Ba2+=BaSO4↓+2H+ 否 若互换三氧化硫也会使B有白色沉淀生成,无法检验二氧化硫 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液; 若高锰酸溶液不褪色,加入KSCN溶液变红 14 2.5a
【解析】
硫酸亚铁铵受热分解产生的气体产物可能为二氧化硫、三氧化硫、水、氨气,A为硫酸亚铁铵受热分解的装置,有水产生时应先用无水硫酸铜检验水,D为检验水的装置,则A连D,氨气为碱性气体,极易溶于水,则氨气能溶于C装置中的溶液中,三氧化硫与水反应生成硫酸根,硫酸根与钡离子结合生成白色沉淀硫酸钡,由此可以检验并除去三氧化硫,C为检验三氧化硫并去除三氧化硫和氨气的装置,则D连C,二氧化硫在酸性溶液中溶解度极小,所以二氧化硫不溶于D,二氧化硫具有还原性,能被双氧水氧化成硫酸根而能与氯化钡生成硫酸钡白色沉淀,由此可以检验二氧化硫,B为检验二氧化硫的装置,则C连B,随后B连 E,由此可知,装置的正确连接顺序为ADCBE。
(1)由分析可知,装置的正确连接顺序为ADCBE,实验前通入氮气是为了排除装置内的空气,防止对实验造成干扰,减少实验误差,故答案为:ADCBE;实验前通入氮气是为了排除装置内的空气,防止对实验造成干扰,减少实验误差;
(2)由分析知,C为检验三氧化硫并去除三氧化硫和氨气的装置,除去三氧化硫是为了避免对二氧化硫的检验造成干扰;B中双氧水氧化二氧化硫并与氯化钡生成沉淀的离子方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+;因为三氧化硫也能使B装置中产生白色沉淀,则无法检验产生的气体中是否含有二氧化硫,则装置B与装置C不能互换,故答案为:检验生成的气体中是否有三氧化硫,并除去三氧化硫和氨气;SO2+H2O2+Ba2+=BaSO4↓+2H+;否;若互换三氧化硫也会使B有白色沉淀生成,无法检验二氧化硫;
(3)验证固体残留物仅为Fe2O3,而不含FeO,则需将固体物质溶于酸,然后检验铁离子和亚铁离子即可,实验步骤为:取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液;预期现象:若高锰酸溶液不褪色,加入KSCN溶液变红,故答案为:取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液;若高锰酸溶液不褪色,加入KSCN溶液变红;
(4)Fe2O3的质量为80g,物质的量为0.5mol,则硫酸亚铁铵的物质的量为1mol,硫原子的物质的量为2mol,而B装置中时二氧化硫最后转化成硫酸钡2mol,由此可知产物中无三氧化硫,则硫酸亚铁铵受热分解的方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,m(N2)=
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,m(N2)= ![]() =14g,故答案为:14;
=14g,故答案为:14;
(5)1mol亚铁离子被氧化后转化成铁离子,失去的电子为1mol,每生成1molCr3+转移的电子为3mol,根据元素得失电子守恒有3n=m,由根据FeOFemCrnO3中化合价的代数和为0,有3m+3n=6,解得m=1.5,n=0.5,则根据铁原子守恒,若得到amolFeOFemCrnO3需消耗硫酸亚铁铵的物质的量为(1+m)a=(1+1.5)a=2.5amol,故答案为:2.5a。


科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式____,其缺点是____(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是____。
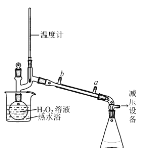
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是____(写1点)。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过下图将H2O2稀溶液浓缩,冷水入口是____(填a或b),增加减压设备的目的是____。
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加____________。
III.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c
B. 达到新平衡时,物质X的转化率减小
C. 压缩容器的容积时,υ正增大,υ逆减小
D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期《美国化学会杂志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在479℃、80Mpa下合成金刚石,这具有深远的意义。
⑴二氧化碳合成金刚石是______变化。
⑵金刚石和______互称 “同素异形体”,只含有______键。
⑶钠与二氧化碳反应生成金刚石与碳酸钠的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
图Ⅰ 图Ⅱ
图Ⅱ
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D. 200 ℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.若12C原子的质量为a g,A原子的质量为b g,则A元素的相对原子质量为![]()
B.氯化钠晶体不导电,但存在钠离子和氯离子
C.黄色晶体碳化铝,熔点2200℃,熔融态不导电,可能是原子晶体
D.18O2与16O2化学性质相似,物理性质有所不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是
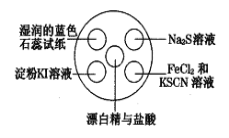
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉KI溶液变蓝 | 氯气置换出KI中的碘使淀粉变蓝 | 单质氧化性:Cl2>I2 |
B | Na2S溶液中出现淡黄色沉淀 | 氯气置换出Na2S中的硫 | 单质氧化性:Cl2>S |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D | FeCl2和KSCN溶液的小液滴变红 | FeCl2被Cl2氧化成FeCl3后,再与KSCN溶液反应变红 | 氯气具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学,为测定某含铜3%~5%的铝铜合金(不含其它元素)中铜的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___。
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥___mL。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铜的质量分数将__(填“偏高”、“偏低”或“无影响”)。
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因___。
(4)实验结束时 ,生成氢气的体积近似等于___。
(5)锥形瓶中残存的氢气对实验结果是否有影响___(填“有”“没有”或“不能判断”)
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。
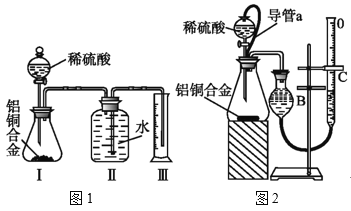
①装置中导管a的作用是___。
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com