
【题目】已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
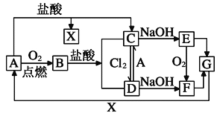
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
【答案】磁性氧化铁 防止Fe2+被O2氧化 3Fe+4H2O ![]() Fe3O4+4H2 置换反应 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3 Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O 2Fe2+ + Cl2=2Fe3+ + 2Cl-
Fe3O4+4H2 置换反应 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3 Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O 2Fe2+ + Cl2=2Fe3+ + 2Cl-
【解析】
A是一种常见金属,燃烧后生成的氧化物B与盐酸反应能够生成两种氯化物,符合条件的常见金属是铁,所以由图中转化关系得,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,X为H2,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3。
(1)由分析可知B为Fe3O4,俗名为磁性氧化铁,故答案为:磁性氧化铁;
(2)因为Fe2+极易被O2氧化,所以保存FeCl2溶液时需加入少量Fe,Fe与水蒸气反应的化学方程式为3Fe+4H2O ![]() Fe3O4+4H2,该反应属于置换反应,故答案为:防止Fe2+被O2氧化;3Fe+4H2O
Fe3O4+4H2,该反应属于置换反应,故答案为:防止Fe2+被O2氧化;3Fe+4H2O ![]() Fe3O4+4H2;置换反应;
Fe3O4+4H2;置换反应;
(3)Fe(OH)2沉淀在空气中被氧化生成Fe(OH)3,可观察到的现象是白色沉淀迅速变成灰绿色,最终变成红褐色,化学方程式为:4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3;故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2 + 2H2O+O2 = 4Fe(OH)3;
(4)Fe3O4与盐酸反应得化学方程式为Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O,FeCl2与Cl2反应得离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4H2O;2Fe2+ + Cl2=2Fe3+ + 2Cl-。


科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
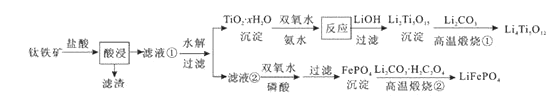
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是一种重要的化工原料,熔点为133 ℃、沸点为300 ℃,不溶于冷水,易溶于有机溶剂,广泛应用于医药、感光树脂和食品添加剂。实验室用苯甲醛和乙酸酐[化学式为(CH3CO)2O,有吸湿性,溶于水形成乙酸]制备肉桂酸的反应原理如下:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
过程中发生的副反应如下:
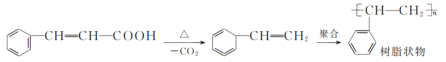
实验步骤如下:
步骤1:在三颈烧瓶中加入3 mL苯甲醛、8 mL乙酸酐和4.2 g K2CO3固体,搅拌,控制温度在150~170 ℃,加热回流45 min。
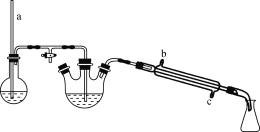
步骤2:向反应液中分批加入20 mL水,再加入Na2CO3固体调节溶液pH至8,然后进行水蒸气蒸馏。(装置如图)
步骤3:待三颈烧瓶中的剩余液体冷却后,加入活性炭,煮沸10~15 min,趁热过滤。
步骤4:将滤液冷却至室温,用盐酸酸化,待晶体析出完全后进行抽滤,用冷水洗涤晶体,干燥得到产品。
(1) 步骤1中,三颈烧瓶使用前必须干燥的原因是________;加入过量乙酸酐的目的是________。
(2) 步骤2中,水蒸气蒸馏时所用装置中玻璃管a的作用是________;冷凝管中冷凝水应从________(填“b”或“c”)口流入。
(3) 步骤3中,加入活性炭的目的是__________________________________。
(4) 步骤4中,抽滤所用的装置包括________、吸滤瓶和抽气泵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
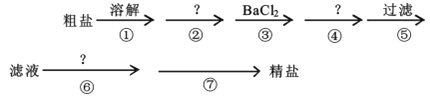
(1)④步所加试剂是___。
(2)第⑥步发生反应的离子方程式为___、___。
(3)第⑦步的操作名称___,需要的玻璃仪器有___、___。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
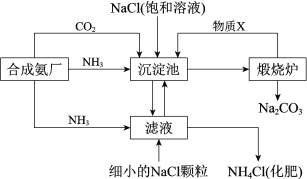
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
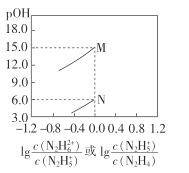
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
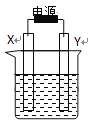
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com