
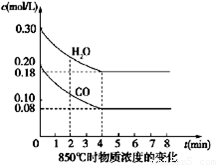
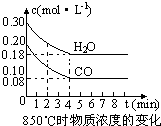
��4�֣���һ���Ϊ10L�ܱյ������У�ͨ��һ������CO��H2O��g������850��ʱ�������·�Ӧ��CO(g)+H2O(g)  CO2(g)+H2(g) ��H��0
CO2(g)+H2(g) ��H��0
��1�� CO��H2OŨ�ȱ仯��ͼ����0��4 min��ƽ����Ӧ���ʦ�(CO)��_______ mol/��L��min������ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ ��
��2����������Щ���������ٷ����仯ʱ������������Ӧ�Ѵﵽƽ��״̬���� ��
A����������ѹǿ
B�����������ܶ�
C��CO�����ʵ���Ũ��
D���ܱ������зų�����
E����(CO)���(CO2)�ı�ֵ
��6�֣��������ƣ�NaClO2����һ��ǿ������Ư�����㷺���ڷ�֯��ӡȾ��ʳƷ��ҵ�����ڼ��Ի������ȶ����ڡ�ijͬѧ�������Ϻ��������NaClO2����Ҫ�������¡�
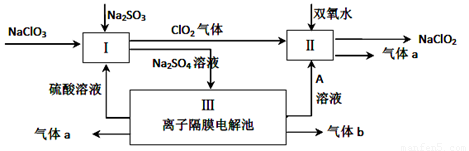
��3����ƽ���з�Ӧ����ʽ ClO3-+ H++ SO32-== ClO2��+ SO42-+
��4��A�Ļ�ѧʽ�� ������������a�ĵ缫��Ӧʽ ��
��4�֣���1��0.03����1�֣�1��1�֣���2��CD ��2�֣�
��6�֣���3��2 ClO3-+ 2 H++ 1 SO32-== 2 ClO2��+ 1SO42-+ 1 H2O ��2�֣�
��4��NaOH����2�֣���4OH-��4e-=2H2O+O2����2�֣�
��������
�����������1����=∆c��∆t=��0.20mol/l−0.08mol•L‾1����4min =0.03mol/��L•min����
������ʽ�����㣺
CO��g��ʮH2O��g�� 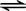 CO2��g��ʮH2 ��g��
CO2��g��ʮH2 ��g��
��ʼ��0.20mol/L 0.30mol/L 0 0
ת����0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
ƽ�⣺0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
��
K=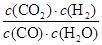 =
=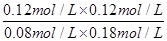 =1��
=1��
��2��A�������Ƿ�ﵽƽ�⣬���������ʵ��������䣬��������ѹǿ���䣬���ܱ����ﵽƽ�⣻B�������Ƿ�ﵽƽ�⣬�������������䣬������䣬���Ի��������ܶȲ��䲻�ܱ����ﵽƽ�⣻C����Ӧ���Ũ�Ȳ��䣬˵����Ӧ�Ѵﵽƽ�⣻D���ܱ������зų��������䣬˵����Ӧ�Ѵﵽƽ�⣻E����(CO)���(CO2)�ı�ֵ��������Ӧ���ʣ������Ƿ�ƽ�ⶼ���䣬���Բ��ܱ�����Ӧ��ƽ�⣬��CD��ȷ��
��3�����ݻ��ϼ���������ClO3‾��ClԪ����+5�۽���ΪClO2�е�+4��Cl��SO32‾��SԪ����+4�����ߵ�SO42‾��+6��S��ͨ�����ϼ������뽵����ֵ��ȿ���ƽ��ѧ����ʽ��
��4����������ͼ��֪����aΪ����������bΪ������ͬʱ����A��NaOH��OH‾ʧ��������O2���缫����ʽΪ��4OH-��4e-=2H2O+O2����
���㣺���⿼�鷴Ӧ���ʺ�ƽ�ⳣ���ļ��㡢��ѧƽ��״̬���жϡ���ѧ����ʽ����ƽ�����ԭ����


 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
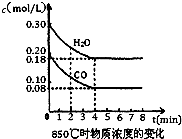
 ��1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ
��1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ| ʱ�䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��֪��Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g����H=-41.2kJ/mol�����ɵ�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ���Ƶ�CH4��
��֪��Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g����H=-41.2kJ/mol�����ɵ�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ���Ƶ�CH4��| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
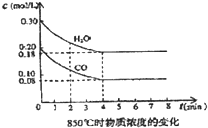 ��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����85��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-Q kJ/mol CO��H2OŨ�ȱ仯��ͼ����
��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����85��ʱ�������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-Q kJ/mol CO��H2OŨ�ȱ仯��ͼ����| ʱ�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��
��һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| ʱ�䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| 0.5��0.5 |
| 0.5��1.5 |
| 1 |
| 3 |
| 0.5��0.5 |
| 0.5��1.5 |
| 1 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/ | 400 | 500 | 800 |
| ƽ�ⳣ��Kc | 9.94 | 9 | 1 |
| ʱ�䣨min�� | CO��g�� | H2O��g�� | CO2��g�� | H2��g�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.120 | 0.220 | 0.080 | 0.080 |
| 3 | 0.080 | 0.180 | 0.120 | 0.120 |
| 4 | 0.100 | 0.200 | 0.100 | C1 |
| 5 | 0.067 | 0.267 | 0.133 | C2 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com