煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知下列两个反应的热效应及平衡常数:
反应①:C(s)+H
2O(g)=CO(g)+H
2(g)
△H1=akJ?mol-1,平衡常数为K
1;
反应②:C(s)+CO
2(g)=2CO(g)
△H2=bkJ?mo1-1,平衡常数为K
2;
又知反应CO(g)+H
2O(g)=CO
2(g)+H
2(g)的平衡常数Kc随温度的变化如下表:
| 温度/ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
回答下列问题:
(1)上述反应中,a
b(填>、<或=),化学平衡常数Kc与K
1、K
2的关系为
.
(2)温度为800℃时,在一体积为10L的密闭容器中,通入一定量的CO和H
2O (g),发生如下反应:CO(g)+H
2O(g)=CO
2(g)+H
2(g),容器内各物质的浓度变化如下表.
800℃时物质的量浓度(mol?L
-1)的变化
| 时间(min) |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.120 |
0.220 |
0.080 |
0.080 |
| 3 |
0.080 |
0.180 |
0.120 |
0.120 |
| 4 |
0.100 |
0.200 |
0.100 |
C1 |
| 5 |
0.067 |
0.267 |
0.133 |
C2 |
①表中0~2min的平均反应速率v(CO)=
.
②表中第3min反应处于
状态(填“平衡”或“非平衡”);
③表中3min~4min之间,平衡向
移动(单选),可能的原因是
(单选);
表中4min~5min之间数值发生变化,可能的原因是
(单选).
a.正反应方向 b.逆反应方向 c.增加水蒸气
d.降低温度 e.使用催化剂 f.增加氢气浓度

(3)如图1、图2表示反应CO(g)+H
2O(g)=CO
2(g)+H
2(g)在t
1时刻达到平衡,在t
2时刻因改变某个条件而发生变化的情况:
①图1中时刻t
2发生改变的条件是
,
②图2中时刻t
2发生改变的条件是
.




 备战中考寒假系列答案
备战中考寒假系列答案 H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表: 2CO(g)平衡常数K;
2CO(g)平衡常数K; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,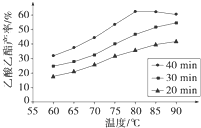 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)