
【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式_____。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:_____。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2![]() 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol -1940kJ/mol CO(g)+FeO(s)=Fe(s)+CO2(g) △H=(3△H1-△H2-2△H3)/6 N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol
2NH3(g) △H=-92kJ/mol
【解析】
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量,则1mol CH4完全燃烧生成CO2和液态水时,放出2×445kJ的热量,因此CH4燃烧的化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol。
(2)反应热等于反应物中键能之和减去生成物中键能之和,则CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H=(4×414+4×155-4×489-4×565)kJ/mol=-1940 kJ/mol;
(3)已知:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
根据盖斯定律可知(①×3-②-2×③)÷6即得到CO还原FeO的热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) △H=(3△H1-△H2-2△H3)/6。
(4) N2 + 3H2![]() 2NH3
2NH3
起始量(mol)1 1 0
转化量(mol)x 3x 2x
平衡量(mol)1-x 1-3x 2x
则1-x+1-3x+2x=1.6,解得x=0.2,所以消耗1mol氮气放出的热量是5×18.4 kJ=92 kJ,则该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ/mol。
2NH3(g) △H=-92 kJ/mol。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是
选项 | 甲 | 乙 | 丙 | 试管中现象 |
A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
B | 浓氨水 | 生石灰 | A1Cl3溶液 | 先沉淀后消失 |
C | 醋酸 | 碳酸钙 | BaC12溶液 | 变浑浊 |
D | 浓硝酸 | 铜 | 水 | 试管口出现红棕色 |
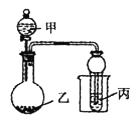
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______________________________________该反应类型______________其中浓H2SO4的作用是_________________和_________________
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置
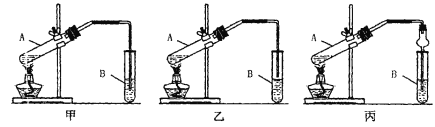
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__________(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是_____________
[实验步骤]①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查_________________
(2)试管B中饱和Na2CO3溶液的作用是_________________________
(3)从试管B中分离出乙酸乙酯的实验操作是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将等物质的量的 CO 和 H2 混合气体充入恒温恒容密闭容器中进行反应:CO(g)+2H2(g)![]() CH3OH(g),下列事实能说明此反应已达到平衡状态的是
CH3OH(g),下列事实能说明此反应已达到平衡状态的是
A. 容器内气体密度保持不变B. 混合气体的平均相对分子质量不变
C. 生成 CH3OH 的速率与生成 H2 的速率相等D. CO 的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定 KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,所得数据如图所示。
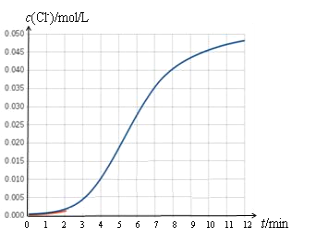
已知:ClO3 + 3HSO3=Cl + 3SO42 + 3H+
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=_________mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步通过测定 c(Cl-)随时间变化的曲线探究影响因素,具体如下表所示。
方案 | 假设 | 实验操作 |
I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
II | 取10mL0.1mol/LKClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液。 | |
III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1mL0.2mol/L 盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液。 |
①补全方案I中的实验操作:_____。
②方案II中的假设为_____。
③除I、II、III中的假设外,还可以提出的假设是_____。
④在已知方案 I 的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_____。
⑤反应后期,化学反应速率变慢的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2B.2:1C.1:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。下列说法正确的是

A. △H3<0 B. △H3+△H4+△H5=△H6
C. △H6>△H5 D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L1 HA中逐滴加入0.1 mol·L1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
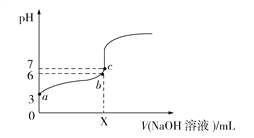
A. b点溶液中H2O电离出的H+浓度大于c点
B. Ka(HA)=106
C. b点溶液中有c(A)c(Na+)=9.9×107 mol·L1
D. c点溶液中的微粒只有A、OH、H+、Na+和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,14 g氮气含有的核外电子数为7 NA
B. 标准状况下,2.24 L![]() 与
与![]() 的混合物中含有的分子数为0.1 NA
的混合物中含有的分子数为0.1 NA
C. 常温常压下,7.8 g苯中含有双键的数目为0.3 NA
D. 常温下,1 L 0.1 ![]() 的
的![]() 溶液中氧原子数为0.3 NA
溶液中氧原子数为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com