
【题目】Al-Ag2O电池用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是

A.电子由Al电极通过外电路流向Ag2O/Ag电极
B.电池负极附近溶液pH下降
C.溶液中OH-向Al电极移动
D.Al极反应式为:Al-3e-+3OH-=Al(OH)3
【答案】D
【解析】
Al-Ag2O电池,电解质为NaOH,Al作负极,Al-3e-+4OH-=AlO2-+2H2O;Ag2O/Ag作正极,发生反应Ag2O+2e-+H2O=2Ag+2OH-。
A、Al是负极,Ag2O/Ag是正极,电子由负极经过外电路流向正极,A正确,不符合题意;
B、负极发生反应Al-3e-+4OH-=AlO2-+2H2O,消耗了OH-,则负极附近溶液的pH下降;B正确,不符合题意;
C、在原电池中,阴离子向负极移动,则OH-向Al电极移动,C正确,不符合题意;
D、电解质溶液中的OH-是过量的,应该生成AlO2-,方程式为Al-3e-+4OH-=AlO2-+2H2O,D错误,符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产![]() ,实验室可用如下装置
,实验室可用如下装置![]() 略去部分加持仪器
略去部分加持仪器![]() 模拟生成过程.
模拟生成过程.
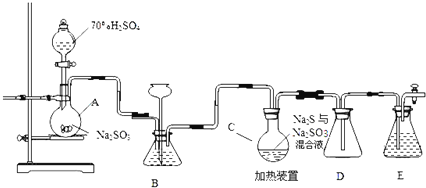
烧瓶C中发生反应如下:
![]()
![]() Ⅰ
Ⅰ![]()
![]()
![]() Ⅱ
Ⅱ![]()
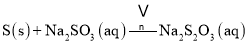
![]() Ⅲ
Ⅲ![]()
(1)装置A中发生的化学反应方程式为 ______
(2)为提高产品纯度,应使烧瓶C中![]() 和
和![]() 恰好完全反应,则烧瓶C中
恰好完全反应,则烧瓶C中![]() 和
和![]() 物质的量之比为 ______ .
物质的量之比为 ______ .
(3)装置B的作用之一是观察![]() 的生成速率,其中的液体最好选择 ______
的生成速率,其中的液体最好选择 ______
a.蒸馏水b.饱和![]() 溶液 c.饱和
溶液 c.饱和![]() 溶液d.饱和
溶液d.饱和![]() 溶液
溶液
实验中,为使![]() 缓慢进入烧瓶C,采用的操作是 ______ .
缓慢进入烧瓶C,采用的操作是 ______ .
(4)已知反应![]() Ⅲ
Ⅲ![]() 相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
相对较慢,则烧瓶C中反应达到终点的现象是 ______ ,装置E的作用为 ______
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出![]() ,其中可能含有
,其中可能含有![]() 、
、![]() 等杂质.利用所给试剂设计实验,检测产品中是否存在
等杂质.利用所给试剂设计实验,检测产品中是否存在![]() ,简要说明实验操作,现象和结论: ______ .
,简要说明实验操作,现象和结论: ______ .
已知:![]() 遇酸易分解:
遇酸易分解:![]() 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液.
溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式。
C6H12O6(葡萄糖)![]() 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______。
(2)画出虚线框内的实验装置图____________,并注明所加试剂,说明装置的作用_____________。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),实验现象为________,化学反应方程式是________________。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是( )

A.元素B、D对应族①处的标识为ⅥA
B.E的含氧酸酸性强于D的含氧酸
C.熔点:D的氧化物<C的氧化物
D.AE3分子中所有原子都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为2∶1的是 ( )
A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com