
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 乙酸乙酯与稀硫酸共热、搅拌 | 液体不再分层 | 乙酸乙酯在酸性条件下完全水解成可溶性物质 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 生成白色沉淀 | 蛋白质发生了变性 |
C | 淀粉在稀硫酸的作用下水解后,加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2g/mL,质量分数为36.5%的浓盐酸配制250mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为__mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、__、__。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是__。
A.量取浓盐酸时俯视刻度线
B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线
D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是( )
A.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.雪是冬之精灵,在雪![]() 水
水![]() 冰的转化中能量变化。ΔH1>0,ΔH2<0
冰的转化中能量变化。ΔH1>0,ΔH2<0
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热量就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2=2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
c(H2)/mol·L-1 | c(Cl2)/mol·L-1 | v/mol·L-1·s-1 |
1.0 | 1.0 | 1.0 k |
2.0 | 1.0 | 2.0 k |
2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1,n=2B.m=1,n=![]()
C.m=![]() ,n=1D.m=
,n=1D.m=![]() ,n=
,n=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)决定化学反应速率的主要因素是参加反应的物质的________,影响化学反应速率的外因有_______________________(至少填2个);
(2)H2C2O4与KMnO4反应时,它转化为CO2和H2O。实验现象________________
(3)氢氧化钡晶体Ba(OH)2·8H2O与氯化铵反应方程式_________________。
(4)Na2S2O3与稀H2SO4反应离子方程式_______________________。
(5)将向含有KI和H2SO4的混合溶液中加入淀粉溶液,放置一段时间实验现象。________
(6)在H2O2溶液中加入少量MnO2实验现象____________
(7)当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则热化学方程式_______________
(8)由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4+Mg→Ti。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
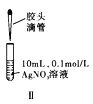
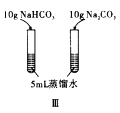
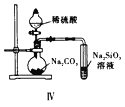
【题目】下列实验方案正确且能达到实验目的的是( )
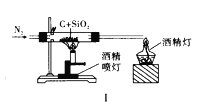
A. 图Ⅰ比较碳、硅两元素非金属性的强弱
B. 图Ⅱ先滴加5滴![]() 的
的![]() 溶液,再滴加5滴
溶液,再滴加5滴![]() 的
的![]() 溶液。比较
溶液。比较![]() 与
与![]() 溶解度的大小
溶解度的大小
C. 图Ⅲ已知溶解度(20℃)![]() :
:![]() ;
;![]() :
:![]() 。室温下,比较
。室温下,比较![]() 和
和![]() 溶解度的大小
溶解度的大小
D. 图Ⅳ证明碳酸的酸性比硅酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:

完成下列问题:
(1)该反应的化学方程式为_____________________。
(2)前2 min用A的浓度变化表示的化学反应速率为______________。
在2 min时,图像发生改变的原因可能是________(用字母表示)。
A.增大压强 B.降低温度
C.加入催化剂 D.增加A的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使一定量的A和B气体混合发生反应:2A(g)+3B(g)![]() C(g)。下列描述中,说明反应已经达到平衡状态的是( )
C(g)。下列描述中,说明反应已经达到平衡状态的是( )
A.各物质的浓度之比c(A):c(B):c(C)=2:3:4
B.混合气体中各物质的浓度相等
C.单位时间内,若消耗了2amolA,同时也消耗了amolC
D.混合气体的体积是反应开始前的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是( )
H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A. ②③④⑤⑥B. ②⑥⑦⑧⑨
C. ①②⑥⑧D. ②⑥⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com