


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n(ClO-) | n(ClO3-) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
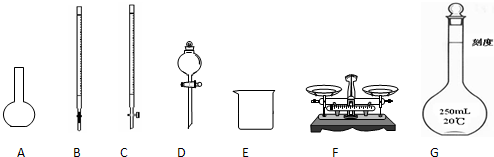
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
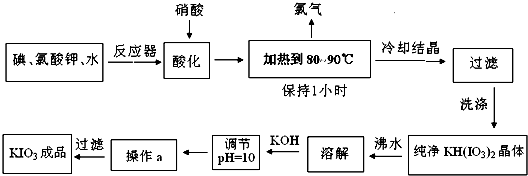
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KOH g/100g水 | 49.2 | 50.8 | 52.8 | 59.8 | 62.4 | 78.6 |
查看答案和解析>>
科目:高中化学 来源:2015届安徽六安新安中学高一上学期期中考试化学试卷(解析版) 题型:填空题
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2
(1)该反应中的氧化剂是__________ ,被氧化的元素是 。
(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量是 mol。
(3) 标出该反应中电子转移情况 。
(4) 若有68g NH3参加反应,电子转移的物质的量是 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com