
����Ŀ�������й���Һ������Ũ�ȵ�˵������ȷ����
A.0.1mol��L-1NaHCO3��Һ��c(Na+)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.Na2Sϡ��Һ��c(H+)=c(OH-)-2c(H2S)-c(HS-)
C.pH=1��NaHSO4��Һ��c(H+)=c(SO42-)+c(OH-)
D.�������ʵ�����NaHC2O4��Na2C2O4����Һ��2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
���𰸡�A
��������
A. NaHCO3�������Na+��HCO3-��HCO3-�ᷢ���������ò���H+��CO32-��Ҳ�ᷢ��ˮ�����ò���H2CO3��OH-������c(Na+)>c(CO32-)������HCO3-�ĵ�������С����ˮ�����ã�����c(H2CO3)>c(CO32-)����Һ�г�HCO3-ˮ�����OH-������ˮ���������OH-������c(OH-)>c(H2CO3)��ˮ�������ü���������c(H2CO3)>c(H+)���ø���Һ����Ũ�ȹ�ϵΪ��c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3) >c(CO32-)>c(H+)��A����
B.��Na2Sϡ��Һ�����������غ�ɵ�c(OH-)=c(H+)+c(HS-)+2c(H2S)������c(H+)=c(OH-)-2c(H2S)-c(HS-)��B��ȷ��
C.NaHSO4�ᷢ�����룺NaHSO4=Na++H++SO42-��������ˮ�ĵ���ƽ�⣺H2O![]() H++OH-�����Ը��������غ�͵���غ��֪pH=1��NaHSO4��Һ������Ũ��Ϊc(H+)=c(SO42-)+c(OH-)��C��ȷ��
H++OH-�����Ը��������غ�͵���غ��֪pH=1��NaHSO4��Һ������Ũ��Ϊc(H+)=c(SO42-)+c(OH-)��C��ȷ��
D.�������ʵ�����NaHC2O4��Na2C2O4����Һ�У����������غ�ɵã�2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]��D��ȷ��
�ʺ���ѡ����A��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����Ҫ�Ĺ�ҵԭ���ϣ�����ͭ��������ͭ��ɵĻ���ij�о���ѧϰС��Ϊ��̽������������ȡ35.2 g��������0.5 L 3.4 mol��L��1��ϡ���ᣬ����������ȫ��Ӧ������һ������4.48 L(��״��)����������Һ�м���aL 2.0 mol��L��1����������Һ��ǡ��ʹ��Һ�е�ͭ���ӳ�����ȫ��
(1)������ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ_______________��
(2)������У�ͭ�����ʵ���Ϊ____________��������ͭ�����ʵ���Ϊ______________��
(3)��������������Һ�������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶���0.1 mol/L��NaHB(ǿ�����)��Һ��c(H��)>c(OH��)�������й�ϵһ����ȷ����(����)
A. c(Na��)��c(HB��)��2c(B2��)��c(OH��)
B. c(Na��)��0.1 mol/L��c(B2��)
C. HB����ˮ�ⷽ��ʽΪHB����H2O![]() B2����H3O��
B2����H3O��
D. �ڸ��ε���Һ�У�����Ũ�ȴ�С˳��Ϊc(Na��)>c(HB��)>c(B2��)>c(OH��)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��Ӧ![]() �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��
�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��

A. ��Ӧ��c ��ﵽƽ��״̬
B. ��Ӧ��Ũ�ȣ�![]() ��С��
����![]() ��
��
C. ��Ӧ��������������������������
D. ![]() ʱ��SO2��ת���ʣ�
ʱ��SO2��ת���ʣ�![]() ��С��
����![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ���Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺����ľ̿��Ũ���ᡢˮ��ͭΪԭ�����ɵ�һ��������������Ʒ�Ӧ�Ʊ��������Ƶ�װ������ͼ��ʾ(���ּг�װ����)��
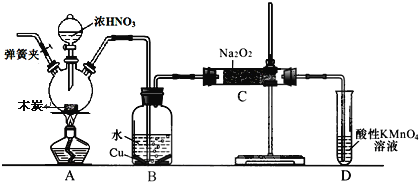
��֪�������£���2NO+Na2O2��2NaNO2
�����������£�NO ��![]() ������
������![]() ��Ӧ����
��Ӧ����![]() �� Mn2+
�� Mn2+
��B �е� Cu ����
���������գ�
(1)д��Ũ������ľ̿��Ӧ�Ļ�ѧ����ʽ__________��
(2)������װ�õ������ԣ�װ��ҩƷ������е�һ��������______________��
(3)D װ�õ������� ________��
(4)������ C �����г�������������и�����̼���ƺ�_______��Ϊ���������Щ������Ӧ�� B��Cװ�ü�����װ�� E��E ��ʢ�ŵ�ҩƷ����________��
(5)�� 7.8g ����������ȫת����Ϊ�������ƣ�������������Ҫľ̿_______________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̵�ص����С�������������dz��õ�һ�ε�ء��õ�ط�Ӧԭ����ͼ��ʾ�����е������LiClO4�����ڻ���л��ܼ��У���������ӣ�Li����ͨ�������Ǩ����������̾����У�����LiMnO2��
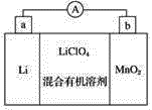
�ش��������⣺
��1�����·�ĵ�����������________������________��������ĸ����
��2����ص�������ӦʽΪ___________��
��3���Ƿ����ˮ�������еĻ���л��ܼ�________����������������������ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6molA�����2molB������2L�ܱ������л�ϲ���һ�������·�����Ӧ��3A��g��+B��g��![]() xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��Lmin��,����д���пհף�
xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��Lmin��,����д���пհף�
��x����ֵΪ �� ��A��ƽ����Ӧ����Ϊ �� ��5minʱB��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2AΪ��Ԫ����,20��ʱ������һ��c(H2A)+c(HA-)+c(A2-)=0.100mol/L��H2A��NaOH�����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������˵���������

A. Ka2(H2A)��������Ϊ10-5
B. NaHA��Һ��:c(H+)>c(OH-)
C. M����ˮ�������c(H+)>N����ˮ�������c(H+)
D. pH=7����Һ��:c(Na+)>2c(A2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� VIII ��Ԫ�أ�������Ԫ�صĽ�����ȣ��������ۡ��е�ߡ�Ӳ�ȸߡ��ܶȴ���ص㣬�������õ���չ�Ժߵ��硢�����ԡ������й����Ǽ��仯����Ľṹ�����ʣ�����д��
��1����[Ni(NH3)6]2+�У�Ni2+��NH3֮���γɵĻ�ѧ����Ϊ________���ṩ�¶Ե��ӵijɼ�ԭ����________��
��2����CoԪ���γ�CoCl3��4NH3����ɫ����CoCl3��4NH3����ɫ����1mol���ֱ���������������Һ��Ӧ�����õ�1molAgCl�����������������������ӵ���λ������________��CoCl3��4NH3����ɫ����CoCl3��4NH3����ɫ���������ͬ����ɫ��ͬ��ԭ����________��
��Co(OH)2Ϊ�������������Ũ��ǿ����Һ�п����γ�[Co(OH)4]2��д��Co(OH)2��ʽ����ĵ��뷽��ʽ__________��
��3���� Co ����ͬ����ͬ��Ĺ���Ԫ��A�����̬ԭ���Ų������ĸ�δ�ɶԵ��ӡ�
���ɴ�Ԫ�ؿɹ��ɹ���X������XΪ�����Ǿ���ķ���Ϊ______________��
��A����CO��Ӧ����A(CO) 5 ����ѹ���۵�Ϊ-20.3�棬�е�Ϊ103.6�棬�þ���������______________��
��A3+��SCN��������1:3�ĸ�������ϣ�������������������ϡ��� A3+��SCN��1:4 �ĸ�������ϣ���ACl3��KSCN��ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ_______��
��A ����������Ԫ��B��C����ij�ֻ����B��C����Χ�����Ų��ֱ�Ϊ3d104s1��3s23p4���侧����ͼ��ʾ�����仯ѧʽΪ_________��
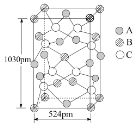
�þ������µ���Ϊ�����Σ���������洹ֱ������ͼ����ʾ��������ʽ����þ�����ܶ�d=__________g�qcm3����������λС����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com