
【题目】将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)![]() xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三容器内分别装有相同压强下的NO、NO2、O2,设三容器容积依次为V1、V2、V3,若将三气体混合于一个容积为V1 + V2 +V3的容器中后,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是( )
A.3∶7∶4B.5∶7∶6C.7∶3∶6D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗CuO粉末(含有Fe2O3和FeO杂质)制备纯净的CuCl2·xH2O晶体。
有关金属离子开始沉淀和沉淀完全时溶液的pH
离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀pH | 5.4 | 8.1 | 2.7 |
沉淀完全pH | 6.9 | 9.6 | 3.7 |
制备方法如下:
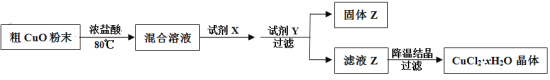
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,试剂X是_______。
(2)加入试剂Y的目的是调节溶液的pH,试剂Y是______,调节pH的范围是_____,生成的固体Z是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的说法不正确的是
A.0.1mol·L-1NaHCO3溶液:c(Na+)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.Na2S稀溶液:c(H+)=c(OH-)-2c(H2S)-c(HS-)
C.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)联氨(N2H4)是二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____(已知:N2H4+H+![]() N2H5+,K=8.7×107,Kw=1×10-14),联氨与硫酸形成的酸式盐的化学式为____。
N2H5+,K=8.7×107,Kw=1×10-14),联氨与硫酸形成的酸式盐的化学式为____。
(2)次磷酸(H3PO2)是一元中强酸,写出其电离方程式:_______。NaH2PO2溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为_______mol·L-1。
(4)如图所示为二元酸H2A溶液中各微粒的物质的量分数(δ)随溶液pH的变化曲线(25C)。

H2A的电离平衡常数Ka1=_______,溶液pH=7时,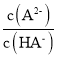 =______。
=______。
(5)25℃时,amolL-1氨水与0.01molL-1的盐酸等体积混合,若混合后所得溶液中c(NH4+)=c(Cl-)。用含a的代数式表示NH3·H2O的电离平衡常数Kb=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
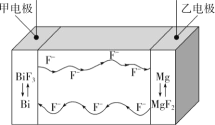
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:

已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
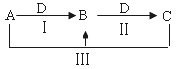
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com