
【题目】下列物质能够导电的是
A.熔融的氢氧化钠B.硝酸钾溶液
C.硫酸铜晶体D.无水乙醇
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】表是现行中学化学教科书中元素周期表的一部分,除标出的元素外。表中的每个编号表示一种元素,请根据要求回答问题:
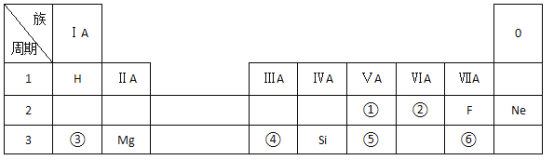
(1)②表示的元素是____________(填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是 ______(填元素符号);其非金属性较强的是 ______(填元素符号);其最高正价氧化物水化物酸性较强的酸是_____(填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
③与⑥两种元素所形成化合物的电子式是____________。
(4)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式________________________。
(5)②与⑥元素的氢化物的稳定性 ______大于______(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A[ | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参加化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒在不同环境下反应 | 反应开始时速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别FeCl3溶液和Fe(OH)3胶体,下列方法中最简单有效的是( )
A. 加入足量的NaOH溶液 B. 加热煮沸
C. 加入足量的盐酸 D. 观察是否产生丁达尔现象(效应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+BC+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。

试回答下列问题:
(1)该反应为_______反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)物质中的化学能通过化学反应转化成_______释放出来。
(4)反应物化学键断裂吸收的能量_______(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。

(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
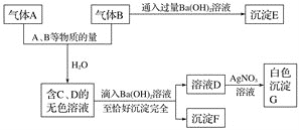
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
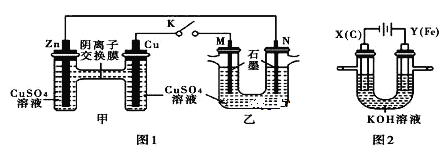
请回答:
用图 1 所示装置进行第一组实验(K 闭合)
(1)Zn 极为_____极。实验过程中,甲中 SO42-________________(填“从左向右”、“从右向左”或“不”)移动;反应初期乙中 N 极发生的电极反应为_________________________________。
(2)反应一段时间后,打开 K,向乙中加入 0.1mol Cu(OH)2 后恰好复原,则上述电解过程中转移的电子数为______________NA。用图 2 所示装置进行第二组实验。实验中两极均有气体产生,且 Y 极区产生 FeO42-,溶液呈浅紫红色。
(3)Y 极上 Fe 变为FeO42-的电极反应式为________________
(4)电解过程中,X 极区溶液的 pH_____(填“增大” 、“减小”或“不变”)。若在 X 极收集到 672 mL 气体,在 Y 极收集到 168 mL 气体(均为标准状况),则 Y 电极质量减少_____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应式为:2K2FeO4+3Zn = Fe2O3 +ZnO+2K2ZnO2 该电池正极发生的电极反应方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com