
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
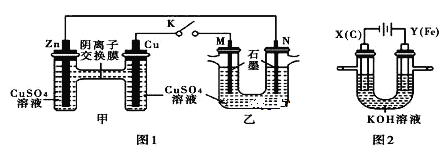
用图 1 所示装置进行第一组实验(K 闭合)
(1)Zn 极为_____极。实验过程中,甲中 SO42-________________(填“从左向右”、“从右向左”或“不”)移动;反应初期乙中 N 极发生的电极反应为_________________________________。
(2)反应一段时间后,打开 K,向乙中加入 0.1mol Cu(OH)2 后恰好复原,则上述电解过程中转移的电子数为______________NA。用图 2 所示装置进行第二组实验。实验中两极均有气体产生,且 Y 极区产生 FeO42-,溶液呈浅紫红色。
(3)Y 极上 Fe 变为FeO42-的电极反应式为________________
(4)电解过程中,X 极区溶液的 pH_____(填“增大” 、“减小”或“不变”)。若在 X 极收集到 672 mL 气体,在 Y 极收集到 168 mL 气体(均为标准状况),则 Y 电极质量减少_____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应式为:2K2FeO4+3Zn = Fe2O3 +ZnO+2K2ZnO2 该电池正极发生的电极反应方程式为_____。
【答案】负 从右向左 Cu2++2e-==Cu 0.4 Fe-6e-+8OH-==FeO42-+4H2O 增大 0.28 2FeO42- +6e- +5H2O = Fe2O3 +10OH-
【解析】
(1)在原电池反应中,活动性:负极>正极;SO42-向正电荷多的区域移动;在电解池中,阳极发生氧化反应,阴极发生还原反应;
(2) 0.1mol Cu(OH)2的作用相当于0.1molCuO和0.1molH2O,加入0.1mol Cu(OH)2的溶液可复原,说明发生反应的物质有CuSO4、水,根据二者的物质的量计算电子转移数目;
(3)Fe是活性电极,阳极,发生氧化反应。结合溶液的酸碱性书写电极反应式;
(4)C作阴极,发生还原反应,根据溶液中c(H+)的改变判断pH变化;
(5)在原电池中,正极上发生还原反应,结合总反应方程式及溶液的酸碱性,可得正极电极反应式。
(1)由于金属活动性Zn>Cu,所以Zn作负极,发生反应:Zn-2e-=Zn2+,Zn2+进入溶液,使负极附近溶液的正电荷增多,根据异种电荷相互吸引,可知甲中SO42-向负极Zn电极区域移动,即从右向左移动;Cu活动性比Zn弱,作原电池的正极。右边的乙池为电解池,其中M电极与原电池的正极相连,作阳极,N电极与原电池的负极相连,作阴极,在阴极上发生还原反应,根据CuSO4溶液中阳离子的活动性:Cu2+>H+,所以在该电极上发生的反应为Cu2++2e-=Cu。
(2) 加入0.1mol Cu(OH)2的溶液可复原,说明发生反应的物质有CuSO4、水,0.1mol Cu(OH)2的作用相当于有0.1molCuO和0.1molH2O反应;n(CuSO4)=0.1mol,转移电子的物质的量为0.1×2=0.2mol,又有0.1mol的水电解,其转移电子的物质的量为0.1×2=0.2mol,因此共转移电子的物质的量为0.4mol电子数目为0.4NA;
(3)在图2电解池中,Fe作阳极,失去电子,发生氧化反应,由于溶液显碱性,所以Y 极上 Fe 变为FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O;
(4)在阴极X电极上,溶液中的H+不断放电产生氢气,使阴极负极溶液中c(OH-)增大,因此附近溶液的pH增大;在X电极发生反应:2H++2e-=H2↑,产生氢气,其物质的量n(H2)=0.672L÷22.4L/mol=0.03mol,在Y电极,首先发生反应:Fe-6e-+8OH-=FeO42-+4H2O,然后发生反应4OH--4e-=O2↑+2H2O,产生氧气,析出氧气的物质的量n(O2)=0.168L÷22.4L/mol=0.0075mol。由于同一闭合回路中电子转移数目相等,所以2n(H2)=4n(O2)+6n(Fe),2×0.03mol=4×0.0075mol+6n(Fe),解得n(Fe)=0.005mol,则Y电极减少的Fe的质量为m(Fe)=0.005mol×56g/mol=0.28g;
(5)在正极上高铁酸根离子获得电子被还原,发生还原反应,电极反应式是:2FeO42- +6e- +5H2O = Fe2O3 +10OH-。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
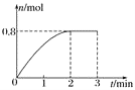
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是__,烧瓶中反应的化学方程式是__。
(2)装置B中盛放液体是__,气体通过装置B的目的是__。装置C中盛放的液体是__。
(3)D中反应的化学方程式是__。
(4)烧杯E中盛放的液体是__,反应的离子方程式是__。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)检查该装置气密性的方法是_______________________________________________。
(2)实验中B装置的作用是____________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E处球形冷凝管的冷却水应从________(填“c”或“d”)口通入。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五种物质中①Ne;②H2O;③NH3;④KOH;⑤Na2O,只存在共价键的是____,只存在离子键的是____,既存在共价键又存在离子键的是____,不存在化学键的是_____.(填写序号)
(2)现有①Na2S、②NH4Cl、③干冰、④碘片四种物质,按下列要求回答:
用电子式表示①的形成过程是_______,用电子式表示④的形成过程是___________②的电子式是________③的电子式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。HIn(aq,红色)![]() H++In-(aq,黄色)。浓度为0.02 mol·L-1的下列各溶液:(1)HCl、(2)H2O2、(3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
H++In-(aq,黄色)。浓度为0.02 mol·L-1的下列各溶液:(1)HCl、(2)H2O2、(3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
A. (1)(4)(5) B. (2)(6) C. (1) (3)(4) D. (5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可以提取镁和溴等物质。
(1)海水淡化的常见方法有____________和_____________;(任写两种)
(2)提取镁的流程如下图所示:

反应①的离子方程式为__________;反应②的化学方程式为___________。
(3)从海水中提取溴的主要操作是:向浓缩的海水中通入氯气,将溴离子氧化。该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com