
【题目】常温下,用![]() 溶液分别滴定浓度均为
溶液分别滴定浓度均为![]() 的
的![]() 、
、![]() 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑![]() 的水解,
的水解,![]() ),下列说法正确的是( )
),下列说法正确的是( )
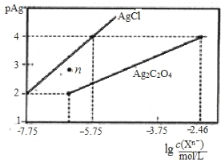
A.![]() 的数量级等于
的数量级等于![]()
B.n点表示![]() 的不饱和溶液
的不饱和溶液
C.向![]() 的混合液中滴入
的混合液中滴入![]() 溶液时,先生成
溶液时,先生成![]() 沉淀
沉淀
D.![]() 的平衡常数为
的平衡常数为![]()
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤 |
B | CO2(CO) | O2 | 点燃 |
C | Fe(Zn) | 稀硫酸 | 结晶 |
D | CO2(HCl) | NaOH溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2 微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。

(1)制备 Cl2 的发生装置可以选用 _________ (填字母代号)装置,发生反应的离子方程式为________________________________________ 。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______→______→ _____→________→_______→______→______→______。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO

①实验室也可用 B 装置制备 NO , X 装置的优点为___________________ 。
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是 ___________________,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
(4)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。
①设计实验证明 HNO2 是弱酸:_________________________________________。(仅提供的试剂:1 molL-1 盐酸、 1 molL-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____亚硝酰氯(ClNO)的质量分数为 _________。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
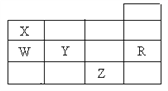
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和, E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___________、____________;
(2)XZ2与YZ2分子的立体结构分别是___________和___________,在水中溶解度较大的是________(填化学式);
(3)Q元素的价电子排布图为___________,在形成化合物时它的最高化合价为_____;
(4)Z与E形成的化合物中,各原子最外层都达到8电子结构,该化合物中心原子采用的轨道杂化方式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,不正确的是( )
 (甲)
(甲)  (乙)
(乙)  (丙)
(丙)  (丁)
(丁)
A. 甲是过量的两份锌粉a、b分别加到100mL等浓度的稀硫酸中,同时向a中加入少量CuSO4溶液,产生H2的体积V(L)与时间(min)的关系图
B. 由乙可知,通电A极上有红色固体析出,说明锌的金属性比铜强
C. 由丙可知,装置工作一段时间后,a极附近溶液的pH増大
D. 由丁可形成铜锌原电池,且电路中每转移2mol电子,在正极会析出64g铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com