
����Ŀ���¶�T��ʱ����3��1L�ĺ����ܱ������з�����C0(g)+H20(g)= C02(g) + H2(g) ��H =-41kJmol-1,����ʼʱͶ�ϵķ�ʽ�������ʵ��������ƽ�������ϵ�����ı仯���±���ʾ��
������� | ��ʼ���������ʵ���/mol | ��ƽ�������ϵ�����ı仯����Ϊ��ֵ�� | |||
C0 | H20(g) | C02 | H2 | ||
�� | 1 | 4 | 0 | 0 | 32.8kJ |
�� | 8 | 2 | 0 | 0 | Q1 |
�� | 0 | 0 | 1 | 4 | Q2 |
����˵������ȷ����
A. ������10s�������з�Ӧ�ﵽƽ�⣬��v(CO)=0.08molL-1s-1
B. �����ں��������������仯��Q2=Q1=32.8kJ
C. ������������ı��˸÷�Ӧ��;������Ӧ�ġ�HҲ��֮�ı�
D. ������ͬ��������ƽ�������������ټ���0.2molCO(g)��0.8molCO2(g) ����ƽ�ⲻ�����ı�
���𰸡�AD
��������
A��ƽ��ʱ�ų�������Ϊ32.8 kJ���ʲμӷ�Ӧ��CO�����ʵ���Ϊ![]() mol=0.8mol������(CO)=
mol=0.8mol������(CO)= =0.08 molL-1s-1����A��ȷ��
=0.08 molL-1s-1����A��ȷ��
B����������
CO(g)+H2O(g)CO2(g)+H2(g)
��ʼ(mol)��4 1 0 0
�仯(mol)��0.8 0.8 0.8 0.8
ƽ��(mol)��0.2 3.20.8 0.8
��ƽ�ⳣ��k=![]() =
=![]() =1�������٢ڢ��¶���ͬ����ƽ�ⳣ����ͬ�����淴Ӧƽ�ⳣ����Ϊ������
=1�������٢ڢ��¶���ͬ����ƽ�ⳣ����ͬ�����淴Ӧƽ�ⳣ����Ϊ������
�������е�ƽ�ⳣ��Ϊ1������������CO�����ʵ����仯��Ϊamol����
CO(g)+H2O(g)CO2(g)+H2(g)
��ʼ(mol)8 2 00
�仯(mol)��a aa a
ƽ��(mol)��8-a2-aa a
ƽ�ⳣ��k=![]() =1�����a=1.6��
=1�����a=1.6��
����������CO2�����ʵ����仯��Ϊbmol����
CO2(g)+H2(g)CO(g)+H2O(g)
��ʼ(mol)��140 0
�仯(mol)��bbb b
ƽ��(mol)��1-b4-bb b
ƽ�ⳣ��k=![]() =1�����b=0.8��
=1�����b=0.8��
�����ں��������з�Ӧ��ı仯�����ȣ��������仯Ҳ���ȣ���B����
C�������ܸı䷴Ӧ���ʣ���Ӱ��ƽ����ƶ���Ҳ���ı䷴Ӧ����H����C����
D��������ͬ��������ƽ�������������ټ���0.2molCO(g)��0.8molCO2(g) ����ʱQc=![]() =1=K����Ϊƽ��״̬����ƽ�ⲻ�����ı䣬��D��ȷ��
=1=K����Ϊƽ��״̬����ƽ�ⲻ�����ı䣬��D��ȷ��
�ʴ�ΪAD��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����(N2H4��H2O)��һ��ǿ��ԭ�Եļ���Һ�壬���������ȼ�ϡ��������ط�����ˮ���µ�ԭ��ΪCO(NH2)2+2NaOH+NaClO=N2H4��H2O+Na2CO3+NaCl��
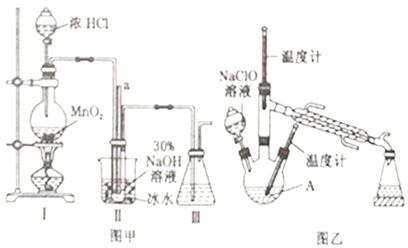
ʵ��1���Ʊ�NaClO��Һ(��֪��3NaClO![]() 2NaCl+NaClO3)��
2NaCl+NaClO3)��
��1��ͼ��װ��������ƿ�ڷ�����Ӧ�����ӷ���ʽΪ________________________��
��2����NaOH��������������������Ϊ30%��NaOH��Һʱ�����貣��������_______________��
��3��ͼ��װ�������ñ�ˮԡ�����¶ȵ�Ŀ����________________________��
ʵ��2����ȡˮ����
��4��ͼ��������Һ©����Һ�ٶȹ��죬����N2H4��H2O�����A �з�Ӧ�������������������Ͳ�Ʒ���ʣ��ù����з�Ӧ���ɵ����Ļ�ѧ����ʽΪ__________________����ַ�Ӧ������A����Һ���ɵõ�ˮ���µĴֲ�Ʒ��
ʵ��3���ⶨ�����ˮ���µĺ���
��5����ȡ���3.0g����������NaHCO3����(�ζ������У�������Һ��pH ������6.5 ����)����ˮ���250mL��Һ���Ƴ�25.00mL������ƿ�У����μ�2~3 �ε�����Һ����0.15mol��L-1�ĵ�ı���Һ�ζ���(��֪��N2H4��H2O+2I2=N2��+4HI+H2O)
���ζ�������������������NaHCO3���壬����������___________��ƫ������ ƫС���� ��Ӱ����)��
�������ܵ��������ˮ���µĺ����ⶨ���ƫ�ߵ���___________(����ĸ)��
a.��ƿ��ϴ�ɾ���δ����
b.�ζ�ǰ���ζ����������ݣ��ζ���������
c.����ʱ���ζ�ǰƽ�ӣ��ζ�����
d.ʢ��Һ�ĵζ���ˮϴ��ֱ��װ��Һ
��ʵ��������I2��Һ��ƽ��ֵΪ20.00mL�������ˮ����(N2H4��H2O)����������Ϊ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ�ǰ�����ڵ�һ���֣�

��1���ж� Y ____ Z _____ R _____(дԪ�ط���)��
��2��д��X���⻯��Ļ�ѧʽ��_________��W���⻯��Ļ�ѧʽ_________����е�Ƚϣ� ________��________ ______________ (�ѧʽ)
��3����ͼ��X�Ļ�̬ԭ�ӵĵ����Ų�ͼ��������һ���Ǵ���ģ���������Ϊ��̬ԭ�ӵĵ����Ų� ͼ����Ϊ��������________��


��4����������Ԫ���У�________(��Ԫ�ط���)Ԫ�ص�һ���������_____Ԫ�ص縺�����Y�Ļ�̬ԭ�ӵĵ����Ų�ʽΪ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��M��X��Y��Z�����ڱ�ǰ36��Ԫ���е����ֳ���Ԫ�أ���ԭ��������������W��һ�ֺ����ڿ���ʱ����������һЩ����������M���������ǵ����������Ҫ����֮һ��X��ijһ�ֵ����Ǵ�����Ⱦ������֮һ��Y�Ļ�̬ԭ�Ӻ�����6��ԭ�ӹ�����ڰ����״̬��Z���γɺ�ɫ��Z2O�ͺ�ɫ��ZO���������
��1��Y3����̬�ĵ����Ų�ʽ�ɱ�ʾΪ ��
��2��MX3���Ŀռ乹�� ����������������
��3��M���γɶ����⻯�����MH3�ļ���ǿ��M2H4��ԭ���� ��
��4�����ݵȵ���ԭ����WX���ӵĽṹʽΪ ��
��5��1 mol WX2�к��е�������ĿΪ ��
��6��H2X������Xԭ�ӹ�����ӻ�����Ϊ ��
��7����Z2+����Һ�м������NaOH��Һ��������Z����λ��Ϊ4����λ���ӣ�д������λ���ӵĽṹʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AG ����Ϊ AG= lg![]() ������ AG ����ʾ��Һ����ȣ�˵������ȷ����
������ AG ����ʾ��Һ����ȣ�˵������ȷ����
A.��һ���¶��£���Һ������Խǿ��AG Խ��
B.65��ʱ��pH �� AG �Ļ��㹫ʽΪ AG = 2 (7 �C pH)
C.����Һ�Լ��ԣ��� AG < 0
D.����Һ�����ԣ��� AG = 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�ݻ��ɱ���ܱ��������Ӧ 2A(g)B(g)+2C(g)�ﵽƽ��ʱ��A��B �� C �����ʵ����ֱ�Ϊ 4mol��2mol��4mol���ڱ����¶Ⱥ�ѹǿ����������£�����˵����ȷ����( )
A.���� 1mol ϡ�����庤(He)��ƽ�⽫�������ƶ�
B.����A��B��C �� 1mol��ƽ�⽫������Ӧ�����ƶ�
C.�� A��B��C �����ʵ����ʵ��������룬C �İٷֺ�������
D.���������������淴Ӧ���ʾ��ӿ죬ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪±�����ڼ��������¿��Է�������ˮ�ⷴӦ��(R ��������)R��X+NaOH![]() R��OH+NaBr��A��B��C��D��E��F��G��H �����л�������������ת����ϵ�����ֻ�����ķ���ʽ�Ѹ�����
R��OH+NaBr��A��B��C��D��E��F��G��H �����л�������������ת����ϵ�����ֻ�����ķ���ʽ�Ѹ�����
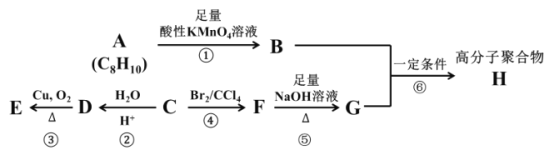
���У�ij�� C ����Ҫ��ʯ�ͻ�����Ʒ�������������������һ�����ҵ�ʯ�ͻ�����չˮƽ�������� A ���ڷ��������ұ����ϵ�������ԭ�ӵ�Ч(������ͬ�Ļ�ѧ����)���߷��Ӿۺ��� H �ǹ�ҵ����Ҫ�ľ�����ά������������������Ȫˮƿ��������ά�������������Ϣ���ش��������⣺
(1)������ A �Ľṹ��ʽΪ _______��A �Ķ��ȴ�����____�֣�A �ķ�������������____��ԭ�ӹ�ƽ�档
(2)��Ӧ�ڵķ�Ӧ������ _____�������� D �й����ŵ�����Ϊ ______��
(3)��д����Ӧ�۵Ļ�ѧ��Ӧ����ʽ______��
(4)��д����Ӧ�Ļ�ѧ��Ӧ����ʽ______����ָ���÷�Ӧ�ķ�Ӧ���ͣ�_____��
(5)��ȡ�������廯���� I �ǻ����� B ��ͬ���칹�壬����������������
���ܷ���������Ӧ���ڲ�����NaHCO3 ��Һ��Ӧ����CO2���۱�����ֻ����һ��ȡ����
��д�� I ���������ֿ��ܵĽṹ��ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�b�缫�ý���M�Ƴɣ�a��c��dΪʯī�缫����ͨ��Դ������M������b����ͬʱa��d�缫�ϲ������ݡ��Իش�
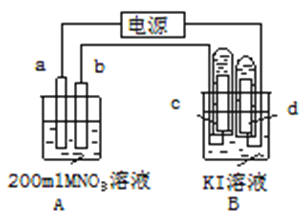
��1��a���ӵ�Դ��__________����b���ĵ缫��ӦʽΪ______________________________��
��2����ʼʱ����B�ձ������룬�μ��ε�����Һ�����ܹ۲쵽�������ǣ�_______________��������һ��ʱ�������C���ϵ��Թ���Ҳ�ռ��������塣��ʱC���ϵĵ缫��ӦʽΪ________________________________
��3����d�����ռ���44.8mL���壨��״����ʱֹͣ��⣬a���Ϸų���__________mol���壬����b�缫�ϳ�������M������Ϊ0.432g����˽�����Ħ������Ϊ___________��
��4�����ֹͣ�������ˮʹA�ձ��е���Һ�����Ϊ200mL��ȡ����Һ��μ��뵽25.0mL0.1mol/L HCl��Һ�У�������25.00mL������Һʱ�պó�����ȫ���Լ�����ǰA�ձ���MNO3��Һ�����ʵ���Ũ��Ϊ__________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����50mL����0.1molCl2����ˮ�еμ�2mol��L1��NaOH��Һ���õ���ҺpH�����NaOH��Һ����ı仯��ͼ��ʾ������˵����ȷ����
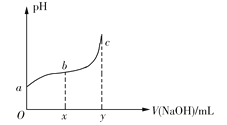
A.��a��pH=4����c(Cl)=mc(HClO)����HClO�ĵ���ƽ�ⳣ��Ϊ![]()
B.��x=100��b���Ӧ��Һ�У�c(OH)>c(H+)������pH��ֽ�ⶨ��pH
C.��y=200��c���Ӧ��Һ�У�c(OH)c(H+)=2c(Cl)+c(HClO)
D.b��c�Σ���NaOH��Һ�ĵ��룬![]() ������
������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com