
����Ŀ��(1)��֪NO2��N2O4�Ľṹʽ����ͼ��ʾ����֪��N��N�ļ���Ϊa kJ/mol��NO2��N2O4��N=O�����ֱܷ���b kJ/mol��c kJ/mol��д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽ________________����H��a��b��c�Ĵ���ʽ��ʾ����

(2)��100��ʱ����0.4mol NO2����2L����������з�����Ӧ��2NO2![]() N2O4�������������������ʵ�����ʱ��仯���±���
N2O4�������������������ʵ�����ʱ��仯���±���
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�����������£�ǰ20s����NO2��ʾ��ƽ����ѧ��Ӧ����Ϊ_________________________���ﵽƽ��״̬ʱ��NO2��ת������________��
��n2_______ n3(����>������=������<��)��
��80sʱ���������ڼ���NO2��N2O4��0.24mol����ѧƽ�⽫_________(����������Ӧ�����ƶ������� ���淴Ӧ�����ƶ����������ƶ���)��
������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬������ʼʱ����Ҫ����������N2O4���壬��N2O4��Ũ��Ϊ_____________��
���𰸡� 2NO2(g) =N2O4(g) ��H = (4b-a-4c) kJ/mol����2NO2(g) N2O4(g) ��H = -(a+4c-4b) kJ/mol�� 0.0025mol/(L��s) 40% < ���ƶ� 0.05mol/L
��������(1)��Ӧ�ȵ��ڶϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ����NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ2NO2(g)=N2O4(g) ��H=(4b��a��4c)kJ��mol��1��(2)��ǰ20s������N2O4��0.05mol�����ݷ���ʽ��֪����NO2��0.1mol��Ũ����0.05mol/L������NO2��ʾ��ƽ����ѧ��Ӧ����Ϊ0.05mol/L��20s��0.0025mol/(L��s)���ﵽƽ��״̬ʱ������N2O4��0.08mol������NO2��0.16mol������NO2��ת������0.16mol/0.4mol��100%��40%����n2��(0.4mol��0.26mol)/2��0.07mol��n3��0.4mol��0.08mol��2��0.24mol�����n2��n3����80sʱ��Ӧ�ﵽƽ��״̬��ƽ�ⳣ��K��![]() ���������м���NO2��N2O4��0.24mol����ʱŨ����Q��
���������м���NO2��N2O4��0.24mol����ʱŨ����Q��![]() �����Ի�ѧƽ�ⲻ�ƶ���������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬����ת����NO2Ӧ������0.4mol�������ҪN2O4ת������0.2molNO2��������ҪN2O40.1mol��Ũ����0.05mol/L��
�����Ի�ѧƽ�ⲻ�ƶ���������NO2����ʼ���ʵ�����Ϊ0.2mol������ͬ�����½���ʵ�飬Ҫ��ﵽ������ƽ����ͬ��ƽ��״̬����ת����NO2Ӧ������0.4mol�������ҪN2O4ת������0.2molNO2��������ҪN2O40.1mol��Ũ����0.05mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ҫ��ӦΪ��Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) - Q
(1)д���÷�Ӧ��ƽ�ⳣ���ı���ʽ_____________________������������________________�������������ƣ�����ʱ������������Ӧ�Ѵﵽƽ�⡣
(2)д��һ�������������Ӧ��������ת���ʵĴ�ʩ__________________��ȡһ�������ȼ����ڸ����½������ȷ�Ӧ��2Al + Fe2O3 ![]() 2Fe + Al2O3��
2Fe + Al2O3��
(3)��������ת�Ƶķ������Ŀ������Ӧ���� 1.5 mol ����ת�ƣ��ɵõ���_______g��
(4)�����ȼ�ֱ�Ӽӵ���������������Һ�У����������ɡ���д���������Ӧ�����ӷ���ʽ��
_____________________________________________
(5)�������ȷ�Ӧ�����ù��������������ܽ⣬���������軯����Һ����Һ����Ѫ��ɫ���ݴ��ܷ�ȷ�Ϲ������Ѳ�����������˵�����ɡ�
______________________________________________________________________
______________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A����ʽΪCxHyOz��15g A��ȫȼ������22g CO2��9gH2O��
(1)���л�������ʽ��___________________��
(2)��A��һ����ɫ�ߴ�ǿ���ݼ�����ζ�����壬���л�ԭ�ԣ�����ṹ��ʽ��_________��
(3)A��ֻ��һ�ֹ����ţ���A��Na2CO3���������ų����ʹ��ܷ���������Ӧ����A�Ľṹ��ʽΪ___________________��
(4)A��ֻ��һ�ֹ����ţ���A���ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ������ṹ��ʽΪ___________________��
(5)��A����ӽṹ�к���6��̼ԭ�ӣ����ж�Ԫ����ȩ�����ʣ�����ṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У�ˮ�Ȳ�����������Ҳ������ԭ����������ԭ��Ӧ�ǣ� ��
A. Na2O2+H2O B. Na2O+H2O
C. Na+H2O D. CO2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�л�������A��B��C��D��E��ת����ϵ����ͼ��ʾ��

��֪һ��̼ԭ�����������ǻ������ȶ���������Ӧ![]() ��
��
��1��������A�еĹ����ŵ�����Ϊ___________��
��2�����й����л�������C��E��˵����ȷ����
��C��E���Է���ˮ�ⷴӦ ��C��E�����ܷ����Ӿ۷�Ӧ
��C������̼ԭ�ӹ�ƽ�� ��E����������KMnO4��Һ��Ӧ
��3��F��B�������IJ���(C5H10O2) ��ͬ���칹�壮F�������ᣬ�������һ�ȴ���ֻ��l �֣���F��ϵͳ����Ϊ_________��
��4����֪D+X��EΪ�ӳɷ�Ӧ��������X�Ľṹ��ʽΪ______��
��5��B������������Һ��Ӧ�����ӷ���ʽΪ_______��
��6���л���E������Na0H��Һ��Ӧ�Ļ�ѧ����ʽΪ_______��
��7��B��ͬ���칹���к��Ȼ�����______��(�����������칹��ͬһ̼ԭ����������˫���Ľṹ)�����к˴Ź�������Ϊ�������л���Ľṹ��ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��ӵķ����У���ȷ����
A. ��ȥ��������������ϩ��������ͨ��Cl2������Һ̬CH2Cl-CH2Cl����Һ����
B. ��ȥ�ױ��еı��������NaOH��Һ���÷�Һ
C. ��ȥ���������е������NaOH��Һ�кͣ�Ȼ������
D. ��ȥ�Ҵ���������ˮ��������ʯ�ң�Ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���( )
ѡ�� | �� | �� | �� | ʵ����� | ʵ��װ�� |
A | ϡ���� | Na2S | AgNO3��AgCl����Һ | Ksp(AgCl)��Ksp(Ag2S) |
|
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | ϡ���� | Na2SO3 | Ba(NO3)2 ��Һ | SO2������Ա��ξ��������ɰ�ɫ���� | |
D | Ũ���� | Na2CO3 | Na2SiO3��Һ | ���ԣ����̼����� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ϊ�ҹ�������������ȫ���Ļ�������֮һ��
������β���ǿ�����Ⱦ����Ҫԭ������β������ԭ��Ϊ��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H <0��
2CO2(g)+N2(g) ��H <0��
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ____________________��
(2)��һ���ݵľ�������(������緢���Ƚ���)��ģ��������Ӧ�������ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴ﵽƽ��״̬����__________��
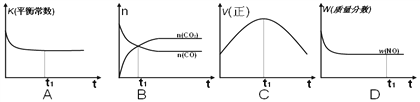
��úȼ�ղ����������к��д���������������������صĻ�����Ⱦ���⡣
(1) ���������ﶼ���γ����ꡣΪ����������������д�ʩ�в����е���_______(�����)��
a.����ú��ȼ�ϡ� b.�ѹ������̴ѼӸߡ� c.ȼ������
d.ȼúʱ������������ e.��������Դ
(2)úȼ�ղ����ĵ��������������CH4����ԭ����֪��
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) ��H =��867kJ/mol
2NO2(g) = N2O4(g) ��H =��56.9kJ/mol
H2O(l) = H2O(g) ��H =+44kJ/mol
д��CH4(g) ��ԭN2O4(g)����N2(g) ��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʪ�����������Ƶ���ˮ��Ư�۾���ˮ��Һ����ʹ��ɫ������ɫ����Ϊ���Ƕ�����
A. Cl2 B. HClO C. ClO D. HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com