
【题目】高温下炼铁的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) - Q
(1)写出该反应的平衡常数的表达式_____________________。当混合气体的________________(填物理量名称)不变时,表明上述反应已达到平衡。
(2)写出一种能提高上述反应中氧化铁转化率的措施__________________。取一定量铝热剂,在高温下进行铝热反应:2Al + Fe2O3 ![]() 2Fe + Al2O3。
2Fe + Al2O3。
(3)请标出电子转移的方向和数目。若反应中有 1.5 mol 电子转移,可得到铁_______g。
(4)将铝热剂直接加到足量氢氧化钠溶液中,有气体生成。请写出该现象对应的离子方程式。
_____________________________________________
(5)若将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色。据此能否确认固体中已不含氧化铁?说明理由。
______________________________________________________________________
______________________________________________________________________
【答案】 K=[c(CO2)]3/[c(CO)]3 质量、平均分子量、密度等(合理即给分) 升高温度、提高一氧化碳的浓度、及时移走二氧化碳等(合理即给分) 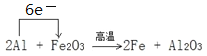 28 2Al + 2H2O + 2OH— → 2AlO2— + 3H2↑ 不能确认、因为所得固体中有铁,会将 Fe3+还原为 Fe2+
28 2Al + 2H2O + 2OH— → 2AlO2— + 3H2↑ 不能确认、因为所得固体中有铁,会将 Fe3+还原为 Fe2+
【解析】 (1)该反应的平衡常数的表达式为K=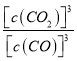 。根据方程式,当混合气体的质量、平均分子量、密度等不变时,表明上述反应已达到平衡,故答案为:K=
。根据方程式,当混合气体的质量、平均分子量、密度等不变时,表明上述反应已达到平衡,故答案为:K=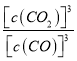 ;质量、平均分子量、密度等;
;质量、平均分子量、密度等;
(2)要提高上述反应中氧化铁转化率,需要平衡正向移动,可以采取的措施有升高温度、提高一氧化碳的浓度、及时移走二氧化碳等,故答案为:升高温度、提高一氧化碳的浓度、及时移走二氧化碳等;
(3)该铝热反应中电子转移的方向和数目表示为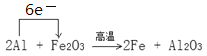 。根据方程式,反应中有 1.5 mol 电子转移,得到铁0.5mol,质量为0.5mol×56g/mol=28g,故答案为:
。根据方程式,反应中有 1.5 mol 电子转移,得到铁0.5mol,质量为0.5mol×56g/mol=28g,故答案为: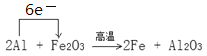 ;28;
;28;
(4)将铝热剂直接加到足量氢氧化钠溶液中,有气体生成,是未反应的铝与氢氧化钠反应放出了氢气,反应的离子方程式为2Al + 2H2O + 2OH— =2AlO2— + 3H2↑,故答案为:2Al + 2H2O + 2OH— =2AlO2— + 3H2↑;
(5)将铝热反应后所得固体用足量盐酸溶解,并加入硫氰化钾溶液,溶液不变血红色。据此不能确认固体中已不含氧化铁,因为所得固体中有铁,会将 Fe3+还原为 Fe2+,故答案为:不能确认;因为所得固体中有铁,会将 Fe3+还原为 Fe2+。


科目:高中化学 来源: 题型:
【题目】(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
CH3OH(g)+H2O(g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+H2(g) △H=Q2kJ·mol-1
CO2(g)+H2(g) △H=Q2kJ·mol-1
②H2O(g)= H2O(I) △H=Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为________________。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
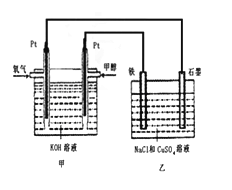
(2)写出甲中通入甲醇这一极的电极反应式_______________________。
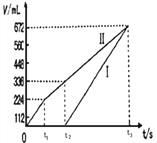
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___________,原混合溶液中NaCl的物质的量浓度为_______mol/L。(设溶液体积不变)
(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_________g。
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是____________。
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,PH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同PH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=________________。(用准确的数学表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 将NaOH固体直接放在托盘天平的托盘上称量
B. 将NaOH固体加水溶解,待所得溶液冷却到室温后,再转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠。其中含极性键的非极性分子是( )
A.②③⑤ B.仅②③ C.仅① D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
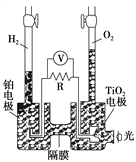
A. 该装置将光能只转化为电能
B. TiO2电极上发生的反应为:2H++2e-===H2↑
C. 该装置工作时,电流由TiO2电极经R流向铂电极
D. 该装置工作时,TiO2电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于醋酸的说法错误的是( )
A. 醋酸分子中含有羟基
B. 醋酸分子中含有醋酸根离子和H+
C. 醋酸分子可看做是甲烷分子中的一个氢原子被羧基取代生成的
D. 醋酸分子中有一个氢原子和其他氢原子不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一烃分子中有一个由C-C键构成的六元环,有一个C=C键,还有一个C≡C键,则能满足上述条件的烃的分子式可能是( )
A. C8H10 B. C14H22 C. C12H22 D. C10H16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com