
����Ŀ�����ö�����̼��������������Ʒ�ǽ������ЧӦ����Ч;��֮һ�����ö�����̼Ϊ��Ҫԭ��������������Ʒ(����ͼ��ʾ)�����˵������ȷ����
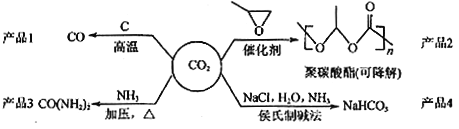
A����ӦCO2(g)+C(s)��2CO(g)����H��0����S��0
B���þ�̼�����������ϩ�ȴ�ͳ���ϣ���������ɫ��Ⱦ
C��CO(NH2)2��NH4CNO��Ϊͬ���칹�壬����ѧ������ͬ
D�������Ƽ�Ĺ��չ�����Ӧ���������ܽ�ȵIJ���
 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�ѹǿ�£�1 L X�����1 L Y������ȫ��Ӧ������1 Lˮ������1 L����.X��Y���������� ( )
A. H2�� N2O B.H2��NO2 C.H2�� N2O3 D.H2��N2O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Na2O2Ͷ��FeCl2��Һ�пɹ۲쵽�������ǣ� ��
A.���ɰ�ɫ����
B.���ɺ��ɫ����
C.�����ݲ���
D.�ޱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ��ȱ������������ٵ��ش����⣬���û�ѧ��Ӧ��ʵ�ֶ�����ʽ�������ת������ش��������⣺
(1������̬��̬ԭ���γ�1mol��ѧ���ͷŵ���������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��ӦN2(g)��3H2(g)![]() 2NH3(g) ��H����93 kJ��mol��1��
2NH3(g) ��H����93 kJ��mol��1��
�Ը��ݱ������м������ݣ�����a ����ֵΪ kJ��mol��
��ѧ�� | H��H | N��H | N��N |
����/kJ��mol��1 | 436 | a | 945 |
��2���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������֪�ڳ�ѹ�������±仯��
�� 2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(g) ��H ��a kJ��mol
�� H2O(g)��H2O(l) ��H ��b kJ��mol
д��Һ̬�״���ȫȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
(3����֪��HCN(aq����NaOH��aq����Ӧ���ʱ��H��-12.1kJ��mol��1; HCl(aq)��NaOH(aq)��Ӧ���ʱ䦤H����55.6 kJ��mol��1����HCN��ˮ��Һ�е�����ʱ䦤H���� ��
(4)��֪��H2(g)+1/2O2(g)=H2O(1) ��H��-285.83kJ��mol��1
CO(g)+1/2O2(g)=CO2(g) ��H��-282.9kJ��mol��1;
��������һ����̼�Ļ��������ȫȼ�տ�����5.4g H2O(l)�����ų�114.3kJ����������������CO�����ʵ���Ϊ (������������ΪС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FԪ����ԭ������������������ֶ�����Ԫ�ء���֪��Ԫ��A��ԭ�Ӱ뾶������Ԫ������С��Ԫ��B��һ��ͬλ�ؿɲⶨ���������Dԭ������������������������֮��Ϊ3��4��E��D�����γ�ԭ�Ӹ�����Ϊ1��1�� 2��1���������ӻ����F��ͬ�����м������а뾶��С��Ԫ�ء��ݴ˻ش��������⡣
(1) FԪ�ص�ԭ�ӽṹʾ��ͼΪ________________��E��Ԫ�����ڱ��е�λ��Ϊ_______________��
(2) CԪ����AԪ���γ�һ������CA![]() ����д��������Һ�д��ڸ����ӵ�ʵ�����������ͽ��ۣ� _____ ____��
����д��������Һ�д��ڸ����ӵ�ʵ�����������ͽ��ۣ� _____ ____��
(3) д��FԪ������������Ӧ��ˮ������NaOH��Һ��Ӧ�����ӷ���ʽ��___________________��
(4) ������ijЩԪ����ɵĻ�����X��Y��Z��W������ת����ϵ(��֪��Y��Z��ˮ��Һ�д�����������ͬ)��
![]()
�� X�������к��еĻ�ѧ��������__________________________��
�� X��Z��Y�����ӷ���ʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У������ں��м��Լ��ķǼ��Է��ӵ�һ���ǣ� ��
A��CO2��H2O�� �� B��C2H4��CH4�� ��C��Cl2��C2H2�� ��D��NH3��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л������ʺͽṹ��������ȷ����
A. �۱�ϩ��ʹ���Ը��������Һ��ɫ
B. ���������м�����������Һ�����ɵ���ɫ����
C. CH4��CCl4��CF2Cl2��Ϊ��������ṹ�ķ���
D. �����ڶ������ֻ��һ�֣�˵����������̼̼���ļ�����ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 3.6 g ̼�� 6.4 g ��������ȼ�գ�����Ӧ��ľ������ų� X kJ ��������֪���� C(s)��ȼ������ֵΪ Y kJ��mol��1���� 1 mol C(s)�� O2(g)��Ӧ���� CO(g)�ķ�Ӧ�� ��H Ϊ�� ��
A. -Y kJ/mol B. -(10X��Y) kJ/mol C. -(5X��0.5Y) kJ/mol D. +(10X��Y) kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�У�PΪһ�����ɻ����Ļ������ر�K���ֱ�������A��B�и�����1 mol X��1 mol Y����ʼʱ��VA��a L��VB��0.8a L����ͨ�ܵ�������Բ�����������ͬ�¶Ⱥ��д������ڵ������£��������и��Է���������Ӧ��3X��g����3Y��g��![]() 2Z��g����2W��g������ƽ��ʱ��VB��0.6a L���ش��������⣺
2Z��g����2W��g������ƽ��ʱ��VB��0.6a L���ش��������⣺
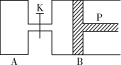
��1���ﵽƽ��ʱB��X��ת����Ϊ________________��
��2��ƽ��ʱA��B�л�������ƽ����Է��������Ĺ�ϵ�ǣ�MA____________MB������>��������������<������
��3����K��һ��ʱ���Ӧ�ٴδﵽƽ�⣬��B�����Ϊ____________L��
��������ҵ�в����ʵ��Ĵ������÷�ӦCO��g����2H2��g��![]() CH3OH��g������ȡ�״���
CH3OH��g������ȡ�״���
��4��ά����ϵ��ѹǿһ�����¶�ΪTʱ�������Ϊ2.0 L�ķ�������ڳ���0.6 mol CO��0.4 mol H2���ﵽƽ��ʱ����0.15 mol CH3OH��g������÷�Ӧƽ�ⳣ��K��________��������λС��������ʱ����������ͨ��0.7 mol CO���壬���ƽ�⽫____________���������������������������������ƶ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com