
����Ŀ����Դ��ȱ������������ٵ��ش����⣬���û�ѧ��Ӧ��ʵ�ֶ�����ʽ�������ת������ش��������⣺
(1������̬��̬ԭ���γ�1mol��ѧ���ͷŵ���������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��ӦN2(g)��3H2(g)![]() 2NH3(g) ��H����93 kJ��mol��1��
2NH3(g) ��H����93 kJ��mol��1��
�Ը��ݱ������м������ݣ�����a ����ֵΪ kJ��mol��
��ѧ�� | H��H | N��H | N��N |
����/kJ��mol��1 | 436 | a | 945 |
��2���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������֪�ڳ�ѹ�������±仯��
�� 2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(g) ��H ��a kJ��mol
�� H2O(g)��H2O(l) ��H ��b kJ��mol
д��Һ̬�״���ȫȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
(3����֪��HCN(aq����NaOH��aq����Ӧ���ʱ��H��-12.1kJ��mol��1; HCl(aq)��NaOH(aq)��Ӧ���ʱ䦤H����55.6 kJ��mol��1����HCN��ˮ��Һ�е�����ʱ䦤H���� ��
(4)��֪��H2(g)+1/2O2(g)=H2O(1) ��H��-285.83kJ��mol��1
CO(g)+1/2O2(g)=CO2(g) ��H��-282.9kJ��mol��1;
��������һ����̼�Ļ��������ȫȼ�տ�����5.4g H2O(l)�����ų�114.3kJ����������������CO�����ʵ���Ϊ (������������ΪС��)
���𰸡���1��391��
��2��2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(l)��H����a+4b��kJ��mol��
��3����43.5kJ��mol��1����4��0.1mol��
��������
�����������1�����ݷ�Ӧ������ܵĹ�ϵ����H=��Ӧ������ܺͣ�����������ܺ�=(945��3��436��2��3��a)kJ��mol��1=��93kJ��mol��1�����a=391��(2)�״�ȼ�յķ�Ӧ����ʽΪ2CH3OH �� 3O2��2CO2 �� 4H2O���� �� 4�������ó���2CH3OH(l) �� 3O2(g)��2CO2(g) �� 4H2O(l)��H ����a+4b��kJ��mol����3����HCN��aq��![]() H �� ��aq�� �� CN����aq�� ��H1����H �� ��aq�� �� OH����aq�� = H2O(l) ��H2 = ��55.6kJ��mol��1����NaOH��aq�� �� HCN��aq�� = NaCN��aq�� �� H2O(l)����H3 = ��12.1kJ��mol��1���� �� �� = ������H1 �� ��H2 = ��H3����H1 = �� 43.5kJ��mol��1��(4)��CO�����ʵ���Ϊxmol,H2�����ʵ���Ϊ5.4 �� 2/(18 �� 2)mol = 0.3�������0.3��285.83 �� 282.9x=114.3�����x=0.1mol��
H �� ��aq�� �� CN����aq�� ��H1����H �� ��aq�� �� OH����aq�� = H2O(l) ��H2 = ��55.6kJ��mol��1����NaOH��aq�� �� HCN��aq�� = NaCN��aq�� �� H2O(l)����H3 = ��12.1kJ��mol��1���� �� �� = ������H1 �� ��H2 = ��H3����H1 = �� 43.5kJ��mol��1��(4)��CO�����ʵ���Ϊxmol,H2�����ʵ���Ϊ5.4 �� 2/(18 �� 2)mol = 0.3�������0.3��285.83 �� 282.9x=114.3�����x=0.1mol��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. ��������������ϡ���3Fe2++4H++NO3���T3Fe3++NO��+3H2O
B. ͭ��ϡ���ᷴӦ��3Cu+8 H++2NO3���T3Cu2++2NO��+4H2O
C. ��Ũ������MnO2��Ӧ��ȡ����������MnO2+2H++2Cl��![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
D. ��ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4��3ClO��+2Fe(OH)3�T2FeO42��+3Cl��+H2O+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѵﵽ����ƽ���0.1 mol/L������Һ�У���ʹƽ�������ķ����ƶ���ͬʱʹ��Һ��pH���ͣ�Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
A������������ B������ C�������������ƾ��� D��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.NaHSˮ�ⷴӦ��HS��+H2O![]() H3O++S2��
H3O++S2��
B������������ˮ�������õ�ԭ��Al3++3H2O![]() Al(OH)3(����)+3H+
Al(OH)3(����)+3H+
C������������Һ��ϡ���ᷴӦ��![]()
D��̼��������Һ�м������Ba(OH)2��Һ��2HCO3��+Ba2++2OH��=BaCO3��+CO32��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�11.2LCO��CO2�����������Ϊ20.4g������������CO��CO2������Ⱥ������ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��������Դ֮һ�����б�����ȷ����( )
A��4��ʱ����ˮ��pH��7
B���¶����ߣ���ˮ�е�c(H��)����c(OH��)��С
C��ˮ�ĵ���̶Ⱥ�С����ˮ����Ҫ������̬��ˮ����
D���ڴ�ˮ�м�����������泥��ɴٽ�ˮ�ĵ��룬ʹˮ�����ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ö�����̼��������������Ʒ�ǽ������ЧӦ����Ч;��֮һ�����ö�����̼Ϊ��Ҫԭ��������������Ʒ(����ͼ��ʾ)�����˵������ȷ����
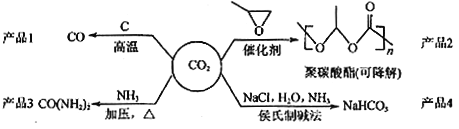
A����ӦCO2(g)+C(s)��2CO(g)����H��0����S��0
B���þ�̼�����������ϩ�ȴ�ͳ���ϣ���������ɫ��Ⱦ
C��CO(NH2)2��NH4CNO��Ϊͬ���칹�壬����ѧ������ͬ
D�������Ƽ�Ĺ��չ�����Ӧ���������ܽ�ȵIJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���SO42����CO32����Cl-��Ϊ�˼��������Ƿ���SO42������BaCl2��Һ�⣬����Ҫ����Һ��(����)
A. H2SO4��Һ B. HCl��Һ
C. NaOH��Һ D. NaNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4NH3��5O2=4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ�������й�ϵ��ȷ����
A. 4v(NH3)��5v(O2) B. 5v(O2)��6v(H2O)
C. 3v(NH3)��2v(H2O) D. 5v(O2)��4v(NO)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com