
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4溶液 B. HCl溶液
C. NaOH溶液 D. NaNO3溶液
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3 ②Al2O3③Al(OH)3 ④Al
A.③④
B.②③
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=-93 kJ·mol-1。
2NH3(g) △H=-93 kJ·mol-1。
试根据表中所列键能数据,计算a 的数值为 kJ/mol。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)已知:HCN(aq)与NaOH(aq)反应的焓变△H=-12.1kJ·mol-1; HCl(aq)与NaOH(aq)反应的焓变ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变ΔH等于 。
(4)已知:H2(g)+1/2O2(g)=H2O(1) △H=-285.83kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) △H=-282.9kJ·mol-1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为 (计算结果保留以为小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都属于含有极性键的非极性分子的一组是( )
A.CO2、H2O B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物性质和结构的叙述正确的是
A. 聚丙烯可使酸性高锰酸钾溶液褪色
B. 向溴乙烷中加入硝酸银溶液,生成淡黄色沉淀
C. CH4、CCl4、CF2Cl2均为正四面体结构的分子
D. 苯的邻二溴代物只有一种,说明苯分子中碳碳键的键长完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、.Z三种短周期元素在周期表中的位置如下图,X元素的单质是空气中含量最高的气体,下列说法不正确的是 ( )
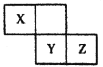
A. X元素韵氢化物和其最高价氧化物对应水化物易发生反应
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. Z的气态氢化物比y的气态氢化物更加稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃ 时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(s)![]() C(g);ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“减慢”或“不变”):
C(g);ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“减慢”或“不变”):
(1)升温__________;
(2)加正催化剂__________;
(3)增大容器容积__________;
(4)加入A__________;
(5)加入C__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com