
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
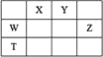
A.T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
B.由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C.W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D.X的氢化物分子中所有原子均满足8电子结构
【答案】A
【解析】
W、X、Y、Z为短周期主族元素,X的一种氢化物与其最高价氧化物对应水化物反应生成盐则X为N元素,根据四个元素在周期表中的位置分析可知,Y为O元素,Z为Cl元素,W为Si元素,T为Ge元素,据此分析解答。
A.Ge位于元素周期表中第四周期第ⅣA族,与C、Si元素同一主族,所以与硅的性质相似,其单质具有半导体的特性,可与O元素形成GeO和GeO2两种化合物,A选项正确;
B.由O、Cl、H三种元素形成的化合物中,氧化性HClO>HClO2>HClO3,跟含氧酸的元素化合价无直接关系,B选项错误;
C.SiO2可与氢氧化钠反应,但不能与水反应,可与氢氟酸发生反应生成四氟化硅和水,C选项错误;
D.X的氢化物为NH3,分子中H原子不满足8电子结构,D选项错误;
答案选A。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=___________;②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是____________(填字母)。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
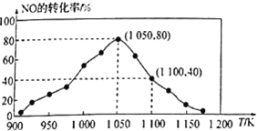
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为___________,在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________(已知:气体分压(P分)=气体总压(Pa)×体积分数)
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①达到平衡后,仅升高温度,k正增大的倍数____________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() = ____________。
= ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
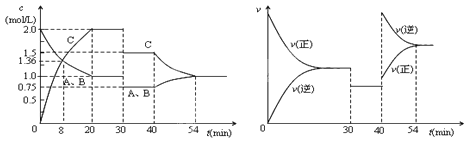
A.前8min A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。[制取氨气的反应原理:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+2H2O ]
CaCl2 + 2NH3↑+2H2O ]
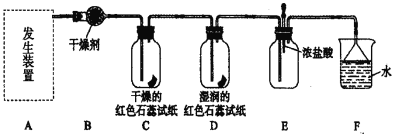
(实验探究)
(1)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。

(2)B装置中的干燥剂可选用________。
(3)用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为________ L。(NH4Cl的摩尔质量为53.5g·mol—1)
(4)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______。
(6)F装置中倒置漏斗的作用_______。
(拓展应用)
(7)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
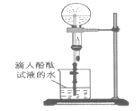
a 还原性 b 极易溶于水 c 与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 =7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1
2CO(g) ΔH=+172.5kJ·mol-1
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
请回答:
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
①0-2min内,用CO表示的反应速率v(CO)=___。
②CO2的平衡体积分数φ=___。
(2)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。CO2、CO的平衡分压(p)与温度(T)的关系如图所示(平衡分压=物质的量分数×总压强)。
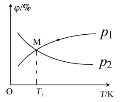
①能表示CO2的平衡分压与温度关系的曲线为___(填"p1”或“p2”),理由是___。
②温度为T1时,该反应的平衡常数K=___;温度升高,K___(填“变小”、“变大”或“不变”)
③实验测得,v正=v(CO2)消耗=k正c(CO2),v逆=v(CO)消耗=k逆c2 (CO),k正、k逆为速率常数,受温度影响,则温度为T1时,k正/k逆=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2碱性溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/mol·L1 | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2碱性溶液脱硝(NO)过程中主要反应的离子方程式:____。增加压强,NO的转化率___(填“提高”“不变”或“降低”)
②由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
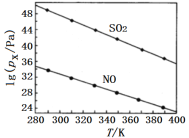
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___(填“增大”“不变”或“减小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图1所示。
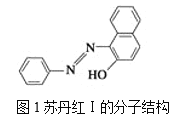
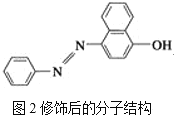
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会____(填“增大”或“减小”),原因是__________________。
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为__________,第二种配合物的结构式为_____。
(3)Ag+能与NH3、S2O32-、CN等形成配位数为2的配合物。
利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有_____(填字母)。
A 离子键 B 金属键 C 配位键 D 非极性键 E 极性键
(4)NO3-中N原子的杂化轨道类型是____,空间构型为_____。写出一种与NO2-,SO2互为等电子体的短周期元素单质分子的化学式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
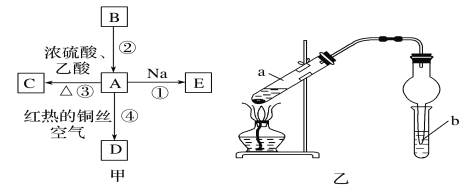
(1)C的结构简式__;A中官能团的名称为__。
(2)写出下列反应的化学方程式:
反应①__;
反应④__。
(3)实验室利用反应③制取C,常用图乙装置:
①a试管中主要反应的化学方程式为__。反应类型是__。
②在实验中用到了:铁架台(铁夹),酒精灯,试管,导管(橡胶管)和__。(填仪器名称)
③试管b中溶液名称为__,实验后观察到的现象是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com