
【题目】(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=___________;②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是____________(填字母)。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
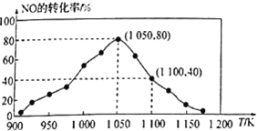
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为___________,在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________(已知:气体分压(P分)=气体总压(Pa)×体积分数)
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①达到平衡后,仅升高温度,k正增大的倍数____________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() = ____________。
= ____________。
【答案】0.021mol·L-1·min-1 BC 1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 4 < ![]()
【解析】
(1)①结合v=△c/△t计算;
②30min后,反应物、生成物浓度均增大;
(2)由图可知1050K前反应末达到平衡状态,在1050K、1.1×106Pa时,NO的转化率为80%,设NO起始量为1mol·L-1,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始 1 0 0
转化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
气体分压(P分)=气体总压(Pa)×体积分数,以此计算Kp;
(3)①焓变为负,为放热反应,升高温度平衡逆向移动;
②在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始 1 1 0 0
转化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡时v正=v逆,即k正/k逆=c(N2)c2(CO2)/c2(NO)c2(CO)。
(1)①0~10min内,平均反应速率v(O2)=(1mol·L-1-0.79mol·L-1)÷10min=0.021mol·L-1·min-1;
②由表中数据可知,30min后,反应物、生成物浓度均增大,则改变条件为通入一定量的O2或适当缩小容器的体积,
故选:BC;
(2)由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;
在1050K、1.1×106Pa时,NO的转化率为80%,设NO起始量为1mol·L-1,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始 1 0 0
转化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
Kp=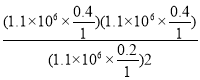 =4
=4
(3)①焓变为负,为放热反应,升高温度平衡逆向移动,则仅升高温度,k正增大的倍数<k逆增大的倍数;
②在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始 1 1 0 0
转化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡时v正=v逆,即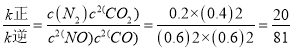 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如下:
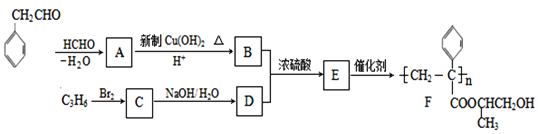
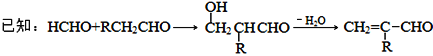
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
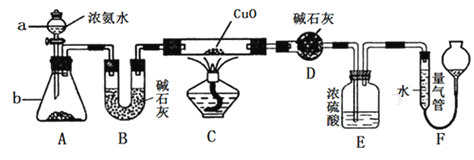
请回答下列问题:
(1)仪器a的名称为_________;仪器b中盛装的试剂为_________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_____________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重ag,装置F中气体的体积为bL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
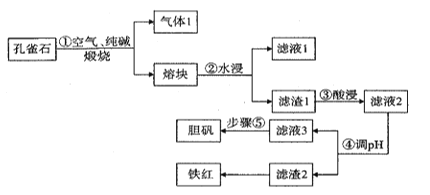
(1)气体1的成分除H2O(g)外,还有_______________,步骤①中发生氧化还原反应的化学方程式为 ___________________________________________________,滤液1的主要成分的用途之一为________________________________________。
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有__________(答出两点)。
(3)步骤④调pH所用试剂为_____________ 。
(4)室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=____________。
(5)步骤⑤操作为___________________________________________________________.。
(6)假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,水存在H2O![]() H++OH--Q的平衡,下列叙述一定正确的是
H++OH--Q的平衡,下列叙述一定正确的是
A. 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B. 将水加热,Kw增大,pH减小
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 向水中加入少量固体NH4Cl,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列反应的方程式:
(1)NO2溶于水的化学反应方程式:__。
(2)实验室制取氨气的化学反应:__。
(3)乙醇与乙酸的酯化反应方程式:__。
(4)红热的碳和浓硝酸的化学反应方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
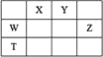
A.T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
B.由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C.W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D.X的氢化物分子中所有原子均满足8电子结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com