
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:阅读理解
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
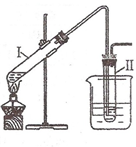 (2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.
(2008?南京一模)实验室用图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.| △ |
| △ |
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. 取少许试管I中收集的有机物于小试管中,加入NaOH溶液,振荡,加热,静置. |
液体分层,上层可能含有NaOH及NaBr. 液体分层,上层可能含有NaOH及NaBr. |
| 2 | 取上层清夜于小试管中,加入过量的稀硝酸酸化. 取上层清夜于小试管中,加入过量的稀硝酸酸化. |
无明显现象. 无明显现象. |
| 3 | 取少许酸化后的溶液用pH试纸检验. 取少许酸化后的溶液用pH试纸检验. |
pH试纸呈红色,溶液呈酸性. pH试纸呈红色,溶液呈酸性. |
| 4 | 向上述酸化的溶液中滴加AgNO3溶液. 向上述酸化的溶液中滴加AgNO3溶液. |
有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 有淡黄色沉淀,溶液中含有Br-,即原有机物中含有Br元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用右图所示的装置制取溴乙烷。在试管I中依次
实验室用右图所示的装置制取溴乙烷。在试管I中依次
加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠
粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _______ 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _______ (任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | _______ | _______ |
| 2 | _______ | _______ |
| 3 | _______ | _______ |
| 4 | _______ | _______ |
(4)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯。在答题卡对应的方框中画出实验装置图,并注明所用试剂的名称。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三3月模拟化学试卷(解析版) 题型:填空题
组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 ????? 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是???????????? 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]=??? ?? 。
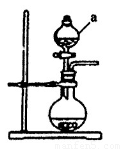
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。
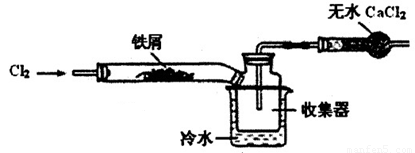
①下列操作步骤的正确排序为??????? (填字母)。
A.体系冷却后,停止通入Cl2
B.通入干燥的Cl2赶尽装置中的空气
C.在铁屑下方加热至反应完成
D.用干燥的H2赶尽Cl2
E.检验装置的气密性
②该实验装置存在的明显缺陷是????????????????? 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O NaClO3+3H2
NaClO3+3H2 ,
,
2NaClO3+4HCl=2C1O2 +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。
有关物质性质:
物质 | 熔点/℃ | 沸点/℃ |
C1O2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图:
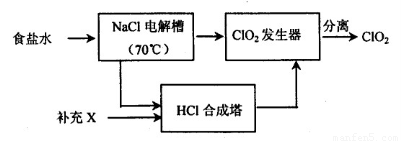
该工艺中,需要补充的物质X为??? (填化学式),能参与循环的物质是?????? (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是???????????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下图所示的装置制取溴乙烷。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。
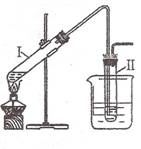
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 (任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
| 实验步骤 | 实验操作 | 预期现象和结论 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
(4)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯。画出实验装置图,并注明所用试剂的名称。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com