
【题目】下列有机实验操作或叙述不正确的是( )
A. 乙酸乙酯中的少量乙酸可用浓的NaOH溶液除去
B. 用银氨溶液检验某病人是否患糖尿病
C. 在酒精中加新制生石灰后蒸馏制无水酒精
D. 用热的纯碱溶液洗涤粘有油脂的试管
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:

(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写除杂试剂及分离提纯的方法(括号中为杂质)
(1)CH4(C2H4):通过盛有 的洗气瓶
(2)乙醇(水):先加 后通过 来加以分离
(3)乙酸乙酯(乙酸):先加 后通过 法加以分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
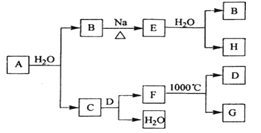
请回答下列问题:
(1)A与水反应的化学方程式为_____________,E与水反应的化学方程式为___________;
(2)F的化学式为___________,G和D的电子式分别为_____________和____________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,价电子的电子排布式_________________,价电子所在电子层的轨道数______;
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___________,B原子的杂化轨道类型是______;
③Li、B、Cl元素的电负性由大到小排列顺序为______________;
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:

M是_______(填元素符号);
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞边长a=480pm,Na+半径为104pm,H-的半径________pm,NaH的理论密度是_______________gcm-3。(用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧 20 mL由两种气态烃组成的混合物,生成50 mL H2O(g)和40 mL CO2(在同温同压下测定)。该混合物是 ( )
A. C2H2C2H4 B. CH4C3H6
C. CH4C4H8 D. C2H6C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中的化学叙述不正确的是( )
A.无法用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3)
B.用聚乙烯制造的塑料薄膜可用于包装食品
C.蚕丝、羊毛、棉花的主要成分都是蛋白质
D.75℅的酒精可用于医用消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2![]() 2SO3 ,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3 ,2 min时,测得O2的物质的量为1.6 mol,则:
(1) 2min内,平均反应速率v(O2)= mol/(L·min)
(2)2min时,SO2的浓度为 mol/L
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com