
【题目】25℃下,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,随滴入NaOH溶液体积的变化混合溶液的pH的变化如图所示。下列说法正确的是( )
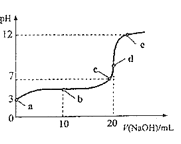
A.A-的水解常数约为10-11
B.水的电离程度:e>d>c>b>a
C.c点和d点溶液中均符合c(Na+)=c(A-)
D.b点溶液中粒子浓度关系:c(A-)>c(HA)>c(H+)>c(OH-)
【答案】D
【解析】
b点溶质为等体积的NaA和HA,形成缓冲溶液,c点为中性点,c(H+)=c(OH-),d点为中和点,溶质只有NaA,溶液显碱性。
A. HA![]() H++A-,其电离平衡常数
H++A-,其电离平衡常数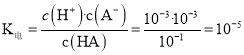 ,A- +H2O
,A- +H2O![]() HA+OH-,其水解平衡常数
HA+OH-,其水解平衡常数![]() ,根据电离平衡常数与水的离子积常数可得,
,根据电离平衡常数与水的离子积常数可得,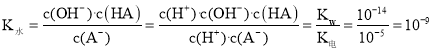 ,A错误;
,A错误;
B. d点恰好反应生成NaA,A-水解,能水解的盐溶液促进水电离,水的电离程度最大,B错误;
C. c点溶液显中性,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(A-),d点溶液显碱性,c(H+)<c(OH-),根据电荷守恒可知:c(Na+)>c(A-),C错误;
D. b点溶液中溶质为等体积的NaA和HA,溶液显酸性,电离过程大于水解过程,粒子浓度关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
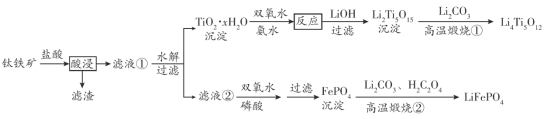
“酸浸”后,钛主要以![]() 形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应![]() ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
A.体积不变,加少许![]() 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深
B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢
C.体积不变,加少许![]() ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅
D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
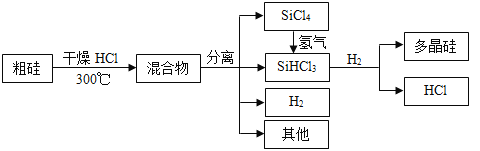
回答下列问题:
Ⅰ.硅粉与![]() 在300℃时反应生成
在300℃时反应生成![]() 气体和
气体和![]() ,放出
,放出![]() 热量,该反应的热化学方程式为________________________。
热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
Ⅱ.将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氢化过程中所需的高纯度![]() 可用惰性电极电解
可用惰性电极电解![]() 溶液制备,写出产生
溶液制备,写出产生![]() 的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
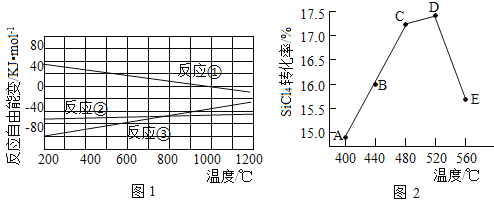
(2)已知体系自由能变![]() ,
,![]() 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的![]() 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的
与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的![]() 小,主要原因是________________________。
小,主要原因是________________________。
(3)不同温度下反应②中![]() 转化率如图2所示。下列叙述正确的是______(填序号)。
转化率如图2所示。下列叙述正确的是______(填序号)。
a.B点: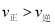 b.
b.![]() :A点
:A点![]() 点 c.反应适宜温度:
点 c.反应适宜温度:![]() ℃
℃
(4)反应③的![]() ______(用
______(用![]() ,
,![]() 表示)。温度升高,反应③的平衡常数
表示)。温度升高,反应③的平衡常数![]() ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除![]() 、
、![]() 和
和![]() 外,还有______(填分子式)。
外,还有______(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。
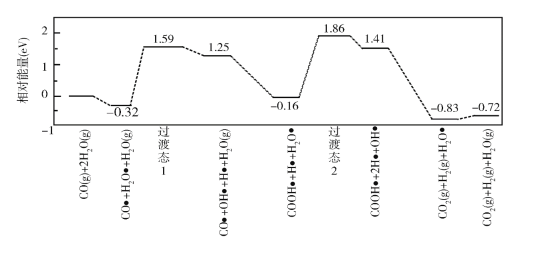
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2![]() HCN+NaNO2 NaCN+HF
HCN+NaNO2 NaCN+HF![]() HCN+NaF NaNO2+HF
HCN+NaF NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出结论D.K(HCN)<K(HNO2)<K(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02gB.8.26gC.8.51gD.7.04g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com