
【题目】下列关于物质工业制法的叙述错误的是
A.陶瓷、玻璃、水泥的生产中均用到了石灰石
B.工业制备高纯硅涉及的主要反应中,所有的反应均为氧化还原反应
C.工业制硫酸过程中,常用98.3%的浓硫酸吸收SO3
D.氨催化氧化是工业制硝酸的基础
【答案】A
【解析】
A.陶瓷的生产原料主要是黏土、玻璃的生产原料主要是纯碱、石灰石和石英,水泥的生产原料主要是石灰石和黏土,故陶瓷的生产中没有用到了石灰石,A符合题意;
B.工业制备高纯硅涉及的主要反应有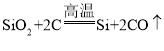 、
、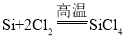 和
和 ,所有的反应均为氧化还原反应,B不符合题意;
,所有的反应均为氧化还原反应,B不符合题意;
C.由于三氧化硫和水反应是放热反应,温度很高,这时水会变为蒸汽,那么水和三氧化硫实际上在气体状态下反应得到硫酸,此时硫酸以酸雾的形成停留在吸收塔中,很难沉降下来,造成水吸收三氧化硫的速度大大降低了,工业制硫酸过程中不用水而常用98.3%的浓硫酸吸收SO3,C不符合题意;
D.工业制硝酸主要的反应有: 、
、![]() 和
和![]() ,所以氨催化氧化是工业制硝酸的基础,D不符合题意;
,所以氨催化氧化是工业制硝酸的基础,D不符合题意;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
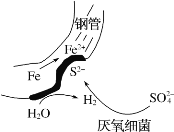
A.正极的电极反应式为O2+4e-+2H2O=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.SO42-与H2的反应可表示为4H2+SO42--8e- S2-+4H2O
S2-+4H2O
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是()
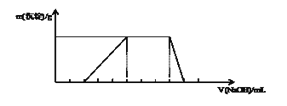
A. H+、NH4+、Mg2+、NO3-
B. H+、Al3+、AlO2-、NH4+
C. H+、NH4+、Al3+、Cl-
D. NH4+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家意外发现一种罕见无机化合物YZX2W3(结构如图所示) ,其中W、X、Y为同一短周期元素, X、Z为短周期同一主族元素且Z的核电荷数是X的2倍,下列说法正确的是

A.元素非金属性强弱顺序为X>Y> W
B.Z的氧化物的水化物是强酸
C.NaY的水溶液不能存放在玻璃试剂瓶中
D.X与Z具有相同的最高化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2 ,还含有少量Fe2O3、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
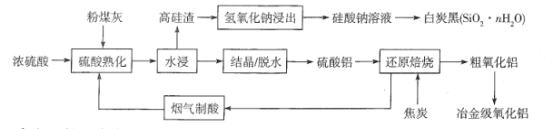
硫酸熟化过程中发生的反应有:
Al2O32SiO2 +3H2SO4=Al(SO4)3 +2SiO2 +3H2O
3Al2O32SiO2 +9H2SO4=3Al2( SO4)3 + 2SiO2 +9H2O
(1)“结晶”操作:缓缓加热,浓缩至______ ,放置冷却,得到Al2(SO4)318H2O。
(2)Al2(SO4)318H2O在250 ~300℃下失重40.5%得Al2(SO4)xH2O,x=______。
(3)“还原焙烧”过程中发生反应的化学方程式为_________。
(4)设计实验检验粗氧化铝中是否含有Fe2O3: __________。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为___________。
(6)粗氧化铝制备冶金级氧化铝过程中发生反应[ Al(OH)4]- +CO2 =Al(OH)3↓+ HCO3- ,该反应的平衡常数为_______[已知 Al(OH)3+H2O![]() [ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3
[ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3![]() H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给的实验装置,下列有关实验的相关叙述正确的是
选项 | 实验装置 | 相关叙述 |
A |
| 实验室可以用该装置和药品制取氨气 |
B |
| 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
C |
| ①中反应比②中快,说明温度升高可以加快反应速率 |
D |
| 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
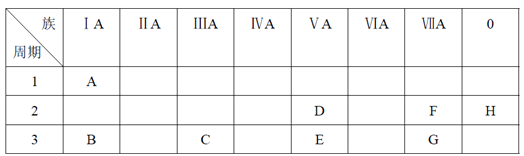
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的常见氧化剂,主要用于化工、防腐及制药工业等。
I.某课外小组设计以锰酸钾制备高锰酸钾的方案如下:
i.锰酸钾的制备:
(1)将二氧化锰、氨酸钾和氢氧化钾固体放入______(填字母)中熔融制锰酸钾。
A.烧杯B.瓷坩埚C.蒸发皿D.铁坩埚
ii.高锰酸钾的制备(装置如图所示,加热及夹持装置省略):
将i中制得的锰酸钾加少量蒸馏水溶解,得墨绿色溶液,倒入三颈烧瓶中。打开甲装置中的分液漏斗活塞加入稀硫酸,加热,使生成的乙酸进入乙装置中并水浴加热。搅拌丙装置中的溶液,锰酸钾在酸性条件下反应生成高锰酸钾和二氧化锰。
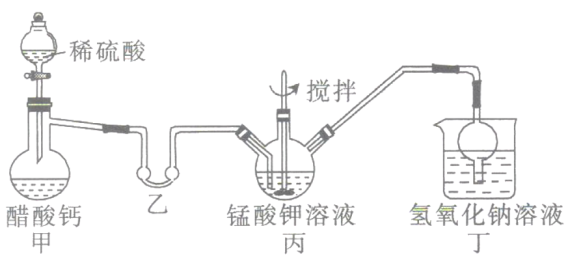
(2)检验该装置气密性的方法:连接好装置,_________________。
(3)乙装置的作用是___________;丁装置中NaOH溶液的作用是____________________。
(4)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,_______、______、抽滤,得到针状的高锰酸钾晶体。高锰酸钾晶体只能低温烘干,其原因为_____________________。
II.利用氧化还原滴定法测定高锰酸钾的纯度,发生反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(5)量取一定体积的高锰酸钾溶液需使用滴定管_______(填字母)。

(6)若在实验过程中存在下列操作,会使所测KMnO4浓度偏高的是____(填字母)。
A锥形瓶用水洗之后末用待测液润洗
B.盛草酸溶液的滴定管滴定前尖嘴部分有气泡,滴定终点时无气泡
C.滴定时,草酸溶液洒落瓶外
D.盛装KMnO4溶液的滴定管用水洗后,未用KMnO4溶液润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com